1、选择题 稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 (?)
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素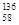 Ce、
Ce、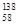 Ce、
Ce、 Ce、
Ce、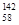 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I-有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑.错误。
参考答案:C
本题解析:A. 金属铈很活泼,所以应该采用电解法制取,电解时铈在阴极析出。错误。B.铈的这四种稳定的核素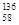 Ce、
Ce、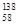 Ce、
Ce、 Ce、
Ce、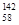 Ce,它们互为同位素。错误。C.符合客观事实及离子方程式的书写原则。正确。D.由于氢碘酸有强的还原性,所以二者反应的化学方程式可表示为:Ce+4HI=CeI4+2H2↑。错误。
Ce,它们互为同位素。错误。C.符合客观事实及离子方程式的书写原则。正确。D.由于氢碘酸有强的还原性,所以二者反应的化学方程式可表示为:Ce+4HI=CeI4+2H2↑。错误。
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.单质铜与稀硝酸反应3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+4H2O
B.钠与水的反应 Na+2H2O=Na++2OH-+H2↑
C.氯气溶于水 Cl2 + H2O = 2H+ + ClO- + Cl-
D.碳酸氢钠跟盐酸反应CO32-+ 2H+= H2O + CO2
参考答案:A
本题解析:A、铜与稀硝酸反应放出一氧化氮气体,符合离子方程式的书写原则,正确;B、电荷不守恒,错误;C、次氯酸是弱酸,不能拆开,错误;D、碳酸氢根离子不能拆成氢离子和碳酸根离子形式,错误,答案选A。
本题难度:一般
3、简答题 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
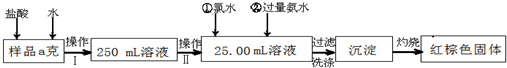
请根据上面流程,回答以下问题:
(1)操作?I?所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有______(填自选仪器名称),操作?II?必须用到的仪器是______?(从以下选项中选择,填编号).
A.50mL烧杯 B.50mL量筒?C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:______
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是______.
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:______.
(5)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是:
______?(用化学方程式表示)
参考答案:(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶、胶头滴管;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管,
故答案为:250mL容量瓶、胶头滴管;D;
(2)加氯水就是让+2价铁变为+3价,发生反应为2Fe 2++Cl2=2Fe 3++2Cl-;加氨水就是使+3价铁充分转化为Fe(OH)3沉淀,发生反应为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;
故答案为:2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
(4)250mL溶液可以得到Fe2O3质量为10(W2-W1)g,铁元素的质量为10(W2-W1)g×112160=7(W2-W1)g,所以原氧化铁样品中铁元素的质量分数=7(W2-W1)a×100%;
故答案为:7(W2-W1)a×100%;
(5)样品溶于水,不加氯水,生成的氢氧化亚铁在蒸干加热时氢氧化亚铁会迅速被氧气氧化为氢氧化铁,加热最终转化为Fe2O3,不影响铁元素质量分数的测定,故该方案可行,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般
4、选择题 下列离子方程式书写正确的是:
A.碳酸氢钙溶液中加入过量的NaOH溶液: Ca2++HCO3―+OH―=CaCO3↓+H2O
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.FeI2溶液中通入少量Cl2:2 Fe2+ + Cl2="2" Fe3+ + 2Cl-
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全NH4++Al3++2Ba2++2SO42-+4OH- =Al(OH)3↓+NH3·H2O+2BaSO4↓
参考答案:D
本题解析:A、碱过量碳酸氢钙完全反应应满足化学式中离子浓度关系,故Ca2++2HCO3―+2OH―=CaCO3↓+CO32―+2H2O,错误;B、溶液为酸性时,完全反应Ba(OH)2,正确为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,错误;C、少量的氯气先氧化碘离子,错误;D、正确。
本题难度:一般
5、选择题 下列反应的离子方程式正确的是( )
A.氯化铁溶液中加入铁粉:Fe+Fe3+=2Fe2+
B.漂白粉溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
C.一小块金属钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
D.小苏打溶液和烧碱溶液反应:HCO3-+OH-=CO3-+H2O
参考答案:A.离子方程式两边电荷不守恒,正确的离子方程式为:Fe+2Fe3+=3Fe2+.故A错误;
B.漂白粉溶液中通入过量二氧化碳,Ca(ClO)2+2CO2+2H20=Ca(HCO3)2+2HClO,正确的离子方程式为:ClO-+H20++CO2=HClO+HCO3-,故B错误;
C.金属钠为单质,应写成化学式,一小块金属钠投入水中:2Na+2H2O=2Na++2OH-+H2↑,故C正确;
D.碳酸根离子离子符号错误,小苏打溶液和烧碱溶液反应,正确的离子方程式为:HCO3-+OH-=CO32-+H2O,故D错误;
故选C.
本题解析:
本题难度:简单