1、选择题 VL含有(NH4)2SO4、NH4NO3的混合溶液,加入a mol NaOH后,加热,恰好使NH3全部逸出;又加入b mol BaCl2则刚好使SO42-完全沉淀,则原混合溶液中NH4NO3的物质的量浓度为(?)
A.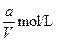
B.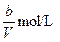
C.
D.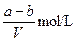
参考答案:C
本题解析:根据混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则
SO42-+Ba2+=BaSO4↓
bmol? bmol
根据加入a mol NaOH后,加热,恰好使NH3全部逸出,则
NH4+?+? OH- NH3↑+H2O
NH3↑+H2O
amol?amol
又因为溶液不显电性,所以由电荷守恒可知,原混合溶液中NH4NO3的物质的量为(a-2b)mol
所以硝酸铵的浓度是 ,所以答案选C。
,所以答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。明确发生的离子反应及溶液不显电性是解答本题的关键,并熟悉浓度的计算公式来解答即可。
本题难度:简单
2、填空题 硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.770 0 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42—)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4—被还原为MnO2,其离子方程式为______________。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:
本题解析::(1)根据Ksp可得出c(Ba2+)=Ksp/c(SO42—)=1.1×10-10/1.0×10-6=1.1×10-4。(2)根据条件可知,非酸性条件下,MnO4—被还原为MnO2,则H2O2被氧化,氧化产物只能为O2,根据得失电子守恒,确定出MnO4—和H2O2的系数,再根据电荷守恒,确定出产物中含有OH-。(3)由②组数据可知沉淀为BaSO4,根据S元素守恒,可得n(Na2SO4)=n(BaSO4)=2.50×10-3 mol;由③组数据,再结合反应2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑可得出n?H2O2?=1.25×10-3 mol;再根据样品的质量,通过质量的关系得出样品中H2O的质量,进一步得出n?H2O?=2.50×10-3 mol;故x∶y∶z=n?Na2SO4?∶n?H2O2?∶n?H2O?=2∶1∶2。所以,硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O。
答案:?1?1.1×10-4
?2?2MnO4—+3H2O2=2MnO2+3O2+2OH-+2H2O
(3)n(Na2SO4)=n(BaSO4)=0.5825/233=2.50×10-3 mol
2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2
n(H2O2)=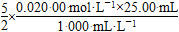 =1.25×10-3 mol
=1.25×10-3 mol
m(Na2SO4)=142 g·mol-1×2.50×10-3 mol=0.355 g
m(H2O2)=34 g·mol-1×1.25×10-3 mol=0.042 5 g
n(H2O)=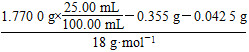 =2.50×10-3 mol
=2.50×10-3 mol
x∶y∶z=n(Na2SO4)∶n(H2O2)∶n(H2O)=2∶1∶2
硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题难度:一般
3、填空题 已知在标况下的四种气体①6.72L CH4 ②3.01×1023个HCl分子 ③13.6克H2S
④0.2molNH3 用相应的序号填写下列空白:
(1)体积最大的是 ;(2)密度最大的是  ;
;
(3)质量最小的是 ;(4)含氢原子数最多的是 。
参考答案:(1)②(2)②(3)④(4)①
本题解析:略
本题难度:一般
4、实验题 (8分)下图是我校实验室化学试剂浓硫酸标签上的部分内容。
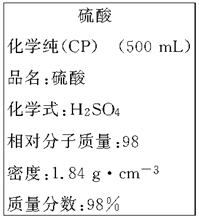
现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
参考答案:(1)500 mL的容量瓶 ;(2)27.2 ; > ;(3)①③⑤
本题解析::(1)配制顺序是:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故答案为:100 mL的容量瓶、玻璃棒; (2)如图所示浓硫酸的浓度为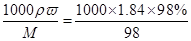 =18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为
=18.4mol/L.稀释前后溶质的物质的量不发生变化,故18.4mol/LxV=480mlx1mol/L,解得V=27.2ml;若将该浓硫酸与等体积的水混合,硫酸溶质的质量不发生变化,质量分数为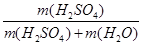 ,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
,由于硫酸的密度大于水的密度,等体积混合硫酸的质量大于水的质量,故质量分数大于49%;(3)根据c=n/V可知,①用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则溶质增加,浓度偏高;②容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,不影响实验结果;③用蒸馏水洗涤量筒,并转移到烧杯中,会使溶质的物质的量偏大,浓度偏高;④转移溶液时,不慎有少量溶液洒到容量瓶外面,则溶质减少,浓度偏小;⑤定容时,俯视容量瓶刻度线进行定容,则容量瓶中溶液体积减少,浓度偏高;⑥定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,则容量瓶中溶液体积增加,浓度偏小,故答案为①③⑤.
考点:一定物质的量浓度溶液的配制
本题难度:一般
5、选择题 下列说法正确的是(? )
A.在常温常压下,11.2 L氧气含有的分子数为0.5NA
B.在常温常压下,1 mol He含有的原子数为NA
C.32g氧气含原子数目为NA
D.在同温同压下,相同体积任何气体单质所含的原子数目相同
参考答案:B
本题解析:常温常压下,11.2L氧气的物质的量不是0.5mol,选项A不正确;氦气是1各原子构成的,选项B正确;氧气是2各氧原子构成的,所以32g氧气含有2mol氧原子,选项C不正确;在同温同压下,相同体积任何气体单质所含的分子数目相同,原子数不一定相等,选项D不正确,答案选B。
本题难度:一般