1、选择题 常温下,在溶液中可以发生反应:X? +? 2Y3+ ="=" X2+ + 2Y2+,则下列解释正确的是
①X被氧化?②X是氧化剂?③X具有还原性?④Y2+是氧化产物?⑤Y2+具有还原性?
⑥Y3+?的氧化性比X2+强
A.②⑤
B.②④⑥
C.①③④
D.①③⑤⑥
参考答案:D
本题解析:X的化合价升高,被氧化,作还原剂,X2+是氧化产物。Y元素的化合价降低,被还原,作氧化剂,Y2+是还原产物。在氧化还原反应中,氧化剂的氧化性大于氧化产物的,还原剂的还原性大于还原产物的,所以正确的答案是D。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.非金属氧化物都是酸性氧化物
B.BaSO4难溶于水,是弱电解质
C.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力
D.可以利用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖
参考答案:D
本题解析:A项非金属氧化物不都是酸性氧化物,如CO不属于酸性氧化物;B项BaSO4是强电解质,因为溶解的BaSO4都完全电离;C项PbI2和AgCl是不同类型的沉淀,不能根据Ksp的大小比较两者的溶解能力;D项正确。
点评:直接考查基本概念,属于较简单题。
本题难度:一般
3、选择题 下列物质的用途中利用了氧化还原反应原理的是(? )
A.用明矾净水
B.用“84消毒液(有效成分为NaClO)”消毒
C.用食盐腌渍食物
D.用小苏打治疗胃酸过多
参考答案:B
本题解析:A是利用明矾水解生成的氢氧化铝吸附造成的。B是利用次氯酸钠的氧化性造成的。C是利用盐溶解使食物和食物所处的环境中的钠离子和氯离子浓度升高,几乎没有生物能在这种环境下生存,食物不易变质。D是利用小苏打的碱性,答案选B。
本题难度:一般
4、选择题 下列变化需加入还原剂的是
A.HCO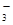 →CO2
→CO2
B.MnO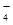 →Mn2+
→Mn2+
C.FeO→Fe3O4
D.Zn→Zn2+
参考答案:B
本题解析:变化需加入还原剂才能实现,说明该物质在反应中一定要做氧化剂,所以化合价一定会降低,从化合价上分析可得答案B.故选B。
点评:熟悉氧化还原反应的规律,此类问题很容易解决。
氧化剂得电子,化合价降低,具有较强氧化性;氧化产物具有较弱氧化性;(因此可判断物质的氧化性强弱)。
还原剂失电子,化合价升高,具有较强还原性;还原产物具有较弱还原性;(因此可判断物质的还原性强弱)。
本题难度:简单
5、选择题 下列化学用语表达正确的是?(?)
A.氯化钠的电子式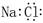 :
:
B.丙烷分子的比例模型:
C.NaHCO3的电离方程式NaHCO3=Na++H++CO32-
D.质子数为53,中子数为78的碘原子:131 53I
参考答案:D
本题解析:氯化钠是离子化合物,由阴阳离子构成,A错。B中所给是球棍模型,不是比例模型,B错。C中,弱酸的酸式酸根HCO3-不能拆,C错。质子数加中子数等于质量数,D对。故选D
本题难度:一般