1、推断题 甲、乙、丙三种物质之间有如图所示的转化关系
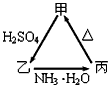
(1)若甲是不溶于水的白色固体氧化物,但既能溶于硫酸又能溶于氢氧化钠溶液,写出下列转化的方程式:
乙→丙的离子方程式______________________________________,
丙→甲的化学方程式______________________________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是_______________(写化学式)
甲→乙的离子方程式是_________________________________________。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+;2Al(OH)3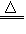 Al2O3+3H2O
Al2O3+3H2O
(2)Fe2O3;Fe2O3+6H+==2Fe3++3H2O
本题解析:
本题难度:一般
2、推断题 (12分)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
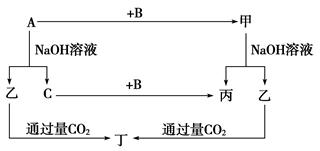
根据图示转化关系回答:
(1)写出下列物质的化学式。
A________________,B________________,
乙________________,丁________________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式_______________________
____________________________________________________________________。
②甲与NaOH溶液反应的离子方程式_______________________
____________________________________________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
参考答案:(1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑ ?②Al2O3+2OH-===2AlO2-+H2O?
(3)0.1 mol 0.3 mol
本题解析:根据图示可知A为Al,C为H2,乙为NaAlO2,丁为Al(OH)3,B为O2,甲为Al2O3,丙为H2O。
Al与NaOH溶液反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,产生3.36L氢气需要0.1mol的Al,1molAl在反应中转移3mol电子,所以转移的电子数为0.3mol。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。解框图题的方法:最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、选择题 在自然界中,既有以化合态存在,又有以游离态存在的元素是
[? ]
A、碳
B、硅
C、镁
D、铝
参考答案:A
本题解析:
本题难度:简单
4、填空题 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有 ??种不同的伸展方向,有 ??种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ??。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为?
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO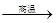 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 ??(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 ??。
a.高温时Al的活泼性大于Ba? b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定? d.Ba的沸点比Al的低
参考答案:
(1)4,13。
(2)GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓。
(3)SiO2+2NaOH= Na2SiO3+H2O,CaAl2Si2O8.
(4)弱,d
本题解析:
(1)铝原子核外电子云有s、p,分别有1、3种伸展方向,其核外有13个电子,则有13种不同运动状态;
(2)类似氯化铝与氢氧化钠溶液反应;
(3)根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式;
(4)该反应是利用Ba的沸点比Al的低,以气体逸出,使平衡右移。
【考点定位】本题考查Al、Ga、Si及其化合物的结构性质等。
本题难度:一般
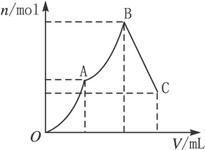
5、填空题 【12分】向100 mL 3 mol·L-1硫酸铝铵溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液。
(1)写出刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):__________。
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。
写出B点和C点对应的Ba(OH)2溶液体积:B. _______________,C._______________。
参考答案:(1)Al3++2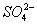 +
+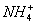 +2Ba2++4 OH-====Al(OH)3↓+2BaSO4↓+NH3·H2O
+2Ba2++4 OH-====Al(OH)3↓+2BaSO4↓+NH3·H2O
(2)600 mL? 750 mL
本题解析:(1)解答本题,首先弄清楚明矾、硫酸铝铵与Ba(OH)2溶液反应的区别:K+与OH-不反应,而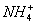 与OH-反应。从图示可看出,在A、B、C三点时反应分别为:
与OH-反应。从图示可看出,在A、B、C三点时反应分别为:
A:2NH4Al(SO4)2+3Ba(OH)2====3BaSO4↓+2Al(OH)3↓+(NH4)2SO4
B:NH4Al(SO4)2+2Ba(OH)2====2BaSO4↓+Al(OH)3↓+NH3·H2O
C:2NH4Al(SO4)2+5Ba(OH)2====4BaSO4↓+Ba(AlO2)2+NH3·H2O
在B点时沉淀的物质的量最大。
(2)在B点时根据反应
n〔Ba(OH)2〕=2n〔NH4Al(SO4)2〕="2×0.1" L×3 mol·L-1="0.6" mol,
故V〔Ba(OH)2〕="0.6" mol÷1 mol·L-1="0.6" L。
在C点时根据反应
n〔Ba(OH)2〕=2.5n〔NH4Al(SO4)2〕="2.5×0.1" L×3 mol·L-1="0.75" mol,
故V〔Ba(OH)2〕="0.75" mol÷1 mol·L-1="0.75" L。
本题难度:简单