1、选择题 下列有关物质用途的叙述中,不正确的是
[? ]
A.二氧化硅可以用于制造变压器的铁芯材料
B.硫可用于制造黑火药
C.二氧化硅可用于制造光导纤维
D.氢氧化铝胶体既能吸附水中悬浮物,又能吸附色素,故可用于净水
参考答案:A
本题解析:
本题难度:简单
2、填空题 (10分)某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:

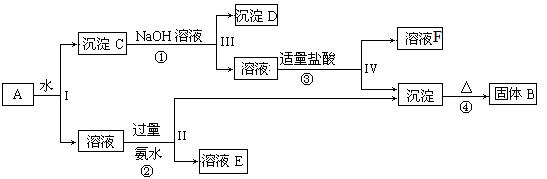
据此回答下列问题:
(1)? I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是?。
(2) 根据上图反应关系,写出下列B、F所含物质成分的化学式:B ?; F?。
?; F?。
(3) 写出过程反应①的离子方程式?,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式?。
(4)写出③中盐酸过量时的离子反应方程式 ? ?。
?。
参考答案:
(10分) (1)过滤(2分)(2)Al2O3、AlCl3(各1分)(3)Al2O3+2OH-=2AlO2-+H2O、
3Fe3O4+8Al 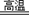 ?4Al2O3 + 9Fe (各2分)(4)AlO2-+ 4H+ = Al3+ + 2H2O(2分)
?4Al2O3 + 9Fe (各2分)(4)AlO2-+ 4H+ = Al3+ + 2H2O(2分)
本题解析:略
本题难度:一般
3、选择题 制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得,用以上两种方法都可制得的氯化物是
[? ]
A.AlCl3
B.FeCl3
C.FeCl2
D.CuCl2
参考答案:A
本题解析:
本题难度:简单
4、选择题 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是
?
| A
| B
| C
| D
|
X
| CO2
| HCl
| NaOH
| AlCl3
|
Y
| Ca(OH)2
| NaAlO2
| AlCl3
| NaOH
|
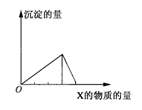
参考答案:C
本题解析:CO2+Ca(OH)2=CaCO3↓+H2O? CO2+CaCO3+H2O=Ca(CO3)2生成沉淀达到最大值,然后沉淀消失,消耗的X的物质的量的比例关系是1:1;
HCl+NaAlO2+H2O=Al(OH)3↓+NaCl? Al(OH)3+3HCl=AlCl3+3H2O生成沉淀达到最大值,然后沉淀消失,消耗的X的物质的量的比例关系是1:3;
3NaOH+AlCl3=Al(OH)3↓+3NaCl? Al(OH)3+NaOH=NaAlO2+H2O生成沉淀达到最大值,然后沉淀消失,消耗的X的物质的量的比例关系是3:1;
AlCl3+4NaOH=NaAlO2+3NaCl? 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl生成沉淀达到最大值,然后沉淀不消失;故选C。
点评:此题要求学生能够熟练掌握物质间的转化反应,此题便不难解决。
本题难度:一般
5、实验题 测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:800 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·mol-1)、水。按如图所示装置进行实验,完成下列问题(设合金样品完全反应,产生的气体体积不超过100 mL)。

(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称最后的合金样品用铜网小心包裹好,放在100 mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:_____________。
参考答案:(1)②在烧杯中注入水,直到水面没过漏斗颈;③在100 mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100 mL空间。④将长颈漏斗(或玻璃棒)插入烧杯并接近烧杯底部,慢慢加入浓盐酸,至有气体产生。
(2)使样品在反应时能保持在烧杯底适当的位置(或答避免反应时样品漂浮)。
本题解析:在题目的第①步操作后,下一步只能是向烧杯中加入水,所加入的水必须浸没漏斗颈口,否则将无法继续操作。然后,将装满水的100 mL量筒倒置于盛水的烧杯中,至于怎样倒置,题目不作要求,但须注意漏斗颈一定要插入量筒内。
组装完成后可以开始反应,由于本题的合金样品全部反应产生的气体体积不会超过100 mL,因此,对加入的盐酸浓度和用量不作要求。
下一步应通过长颈漏斗加入浓盐酸,使用浓盐酸是为了加快反应速率。
由于金属是铝锌合金,密度较小,在跟盐酸反应时可以上下浮动,铝屑或铝片易顺着漏斗漂浮而出,给实验结果造成相当大的误差,所以用不与盐酸反应的铜网包裹,使之不致漂浮。
本题难度:简单