1、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
[? ]
A.pH=2的溶液中:Fe3+、Na+、I-、HCO3-
B.强酸性溶液中:Fe2+、Na+、SO42-、NO3-
C.在c(H+)/c(OH-)=1010的溶液中:NH4+、K+、HCO3-、Cl-
D.加入石蕊呈红色的溶液中:NH4+、Mg2+、NO3-、SO42-
参考答案:D
本题解析:
本题难度:一般
2、填空题 (10分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
阳离子
| K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+
|
阴离子
| OH- HCO3- CO32- Cl- NO3- SO42-
|
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中______(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是________________。
(2)原溶液中所含的阴离子为__________,阳离子为__________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为__________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为__________g。
参考答案:(1)一定不 ;HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;
(2)Cl-、NO3-、SO42-; Fe2+、Mg2+;(3)3Fe2++NO3-+4H+==3Fe3++NO↑+2H2O ;(4)120 。
本题解析:(1)若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化则溶液中不含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;(2)若向原溶液中加入足量的盐酸,反应后溶液中阴离子的种类没有变化,则溶液中也不含大量的OH-。则原溶液中所含的阴离子为Cl- NO3- SO42-,由于Ba2+与SO42-会发生沉淀反应而不能大量存在;还会产生无色气体生成,则由于含有NO3-,说明发生了氧化还原反应,因此一定含有Fe2+,在溶液中含有5种离子,且各种离子的物质的量均为1 mol。阴离子有Cl- NO3- SO42-,则根据电荷守恒可知还应该含有的阳离子是Mg2+;(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+==3Fe3++NO↑+2H2O;(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后产生的沉淀是Fe(OH)2、Mg(OH)2,过滤、洗涤、干燥灼烧至恒重,得到固体是Fe2O3和MgO,其质量为0.5mol×160g/mol+1mol×40g/mol=120g。
考点:考查离子的检验、溶液成分的确定、守恒法在溶液蒸干灼烧至恒重时所得到的固体质量的确定。
本题难度:一般
3、选择题 常温下,将10体积pH=2的盐酸与1体积pH=13的Ba(OH)2溶液混合,混合溶液的c(H+)为?(?)?
A.5.0×10—3mol/L
B.1.0×10—7mol/L
C.1.1×10—12mol/L
D.2.2×10—13mol/L
参考答案:B
本题解析:
反应后溶液中n(OH― )=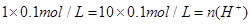 ,溶液呈中性,H+由水电离产生,C(H+?)= 1.0×10—7mol/L,选B
,溶液呈中性,H+由水电离产生,C(H+?)= 1.0×10—7mol/L,选B
本题难度:一般
4、选择题 下列各组离子可以在溶液中大量共存的是( )
A.Na+、Ba2+、NO3-、SO42-
B.H+、K+、Cl-、OH-
C.K+、H+、NO3-、HCO3-
D.K+、Cu2+、Cl-、SO42-
参考答案:A.因Ba2+、SO42-能结合生成沉淀,则不能共存,故A错误;
B.因H+、OH-能结合生成水,则不能共存,故B错误;
C.因H+、HCO3-能结合生成水和气体,则不能共存,故C错误;
D.因该组离子之间不反应,则能共存,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列离子组在指定溶液中能大量共存的是?
A.强酸溶液中:K+、Fe2+、MnO4-、SO2-4
B.滴加石芯试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN-
C.既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、CO32-、SO32-、NO3-
D.常温下 的溶液中:Al3+、NH4+、Cl-、CO32-
的溶液中:Al3+、NH4+、Cl-、CO32-
参考答案:C
本题解析:略
本题难度:一般