1、计算题 水银的沸点是630K,它的蒸发热是296.2Jg,在沸点时,水银变化的熵变△S是 J·mol-1·k-1。
参考答案:94.31
本题解析:
本题难度:一般
2、简答题 (1)已知2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol.某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为______.
(2)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的pH______(填“增大”,“减小”或“不变”)该电池的负极反应式为______.
(3)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的______极,该粗铜精炼电解池的阴极反应式为______.
参考答案:(1)水的物质的量为3.6g18g/mol=0.2mol,
由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.2mol,
由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1可知,0.2molH2燃烧放出的热量为57.16KJ,
则CO燃烧放出的热量为113.74KJ-57.16KJ=56.58KJ,
设混合气体中CO的物质的量为x,则
CO(g)+12O2(g)=CO2(g)△H=-283kJ?mol-1
1 283KJ
x56.58KJ
1x=283KJ56.58KJ,解得x=0.2mol,即n(CO)=0.20mol,
所以原混合气体中H2和CO的物质的量之比为0.2mol:0.2mol=1:1,
故答案为:1:1;
(2)碱性条件下,正极上氧气得电子生成氢氧根离子,所以正极区溶液的pH增大,负极上甲醇失电子生成碳酸根离子,所以负极的电极反应式为:2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:增大;2CH3OH-12e-+16OH-=2CO32-+12H2O;
(3)电解精炼时粗铜作阳极,与正极相连,阴极铜离子得电子生成铜单质,则阴极上电极反应式为:Cu2++2e-=Cu,故答案为:正极;Cu2++2e-=Cu.
本题解析:
本题难度:简单
3、填空题 磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5,现将3.1g的单质磷(P)在3.2g氧气中燃烧至反应物耗尽,并放出X kJ的热量。
(1)反应后生成物的组成(用化学式表示)是______________ 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1molP与O2反应生成固态P2O3的反应热ΔH=__________。
(3)若3.1g磷在3.6g氧气中燃烧,至反应物耗尽,并放出Z kJ的热量,则X______Z(填“<”“>”或“=”)
(4)磷的两种氧化物中,较稳定的是__________________ 。
参考答案:(1)P2O3 、P2O5
(2)-(20X-Y)KJ/mol
(3)<
(4)P2O5
本题解析:
本题难度:一般
4、选择题 在298K、1.01×105Pa下,将22g CO2通入1mol·L-1 NaOH溶液750mL中充分反应,测得反应放出x kJ的热量。已知该条件下,1mol CO2通入2mol·L-1 NaOH溶液1L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
[? ]
A.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) △H=-(8x-2y)kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
5、填空题 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
ΔH=-99kJ·mol-1。请回答下列问题
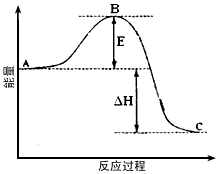
(1)图中A、C分别表示___________、___________,E的大小对该反应的反应热有无影响?______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________,理由是______________________;
(2)图中△H=___________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式______________________;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=___________mol·L-1·min-1、
v(SO3)=___________mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3molSO3(g)的△H (要求计算过程)。
参考答案:(1)反应物能量;生成物能量;无;降低;因为催化剂改变了反应的历程使活化能E降低
(2)-19来源:91exam .org8
(3)SO2+V2O5==SO3+2VO2、4VO2+O2==2V2O5
(4)0.025;0.05
(5)S(s)+O2(g) =2SO2(g)△H1=-296 KJ·mol-1,SO2(g)+1/2O2(g) SO3(g) △H2=-99 kJ·mol-1
SO3(g) △H2=-99 kJ·mol-1
3S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185kJ·mol-1
本题解析:
本题难度:一般