1、选择题 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
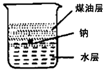
A.钠悬浮在煤油层中
B.钠静止在两液面之间
C.钠沉入水底下
D.钠在两液体界面附近上下跳动
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列各组物质相互作用时,改变反应条件或反应物用量均不会引起产物种类改变的是( )
A.Na在氧气中燃烧
B.CO2通入NaOH溶液中
C.Fe在Cl2中燃烧
D.C在O2中燃烧
参考答案:A.Na和O2反应的温度不同,产物不同,常温下生成氧化钠,点燃生成过氧化钠,故A错误;
B.少量CO2和NaOH溶液反应生成碳酸钠,过量CO2和NaOH溶液反应生成,与反应物的量有关,故B错误;
C.Fe和Cl2的反应温度不同、量不同不会引起产物的改变,故C正确;
D、C和氧气反应,氧气过量时生成二氧化碳,氧气不足时生成一氧化碳,反应物用量比改变,会引起产物的种类改变,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 有关钠的叙述正确的是
[? ]
A.2.3 g钠与97.7 g水反应后溶液中溶质的质量分数等于4%
B.钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜
C.将金属钠与水反应后的溶液中通入适量氯气后,溶液中含有两种溶质
D.钠在空气中的缓慢氧化与其在空气中点燃的产物都一样
参考答案:C
本题解析:
本题难度:简单
4、填空题 在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4==I2 +K2SO4+2H2O
②H2O2+ I2 ==2HIO
③H2O2+ 2HIO== I2 +O2↑+2H2O
(1)H2O2在③中的作用是________(填正确选项的编号)。
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为________(填对或不对),其理由是_________。
(3)上述反应说明H2O2、I2 、HIO氧化性从强到弱的顺序是____________。
参考答案:(1)B;
(2)对;从反应②③可以看出碘在反应前后其质量和化学性质均未改变,在碘的存在下过氧化氢分解放出氧气的速率加快。
(3)HIO>H2O2 >I2
本题解析:
本题难度:一般
5、选择题 下列物质与金属钠反应最剧烈的是
[? ]
A.水
B.HCl溶液
C.NaOH溶液
D.NaCl溶液
参考答案:B
本题解析:
本题难度:简单