1、选择题 人工肾脏可用间接电化学方法除去代谢产物中的尿素[(CO(NH2)2) ],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如右图所示,下列说法正确的是
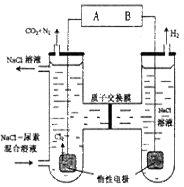
A.B为 电 源 的正 极
B.电解过程中,阳极室附近的PH保持不变
C.电解过程中,电子由电源B端流出经溶液流回到电源A端
D.右边发生的电极反应式为:2H2O +2e-= H2↑+ 2OH-
参考答案:D
本题解析:由题图可知:在与电源B相连的电极处产生H2。根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的水电离产生的H+应该在阴极放电,产生H2。所以B为电源的负极,A为电源的正极。故选项A错误。在电解的过程中,阳极区的代谢产物中的尿素(CO(NH2)2)被氧化为N2、CO2,从体系中逸出。CO2只有在溶液饱和后才可能逸出,所以阳极区为H2CO3的饱和溶液。H2CO3溶液是酸性溶液。因此阳极室附近的PH减小。错误。C. 在外电路中,电子由阴极流向电源的正极,再有电源的负极流向阴极。在内电路,溶液中的阳离子向阴极移动,阴离子向阳极移动,从而形成闭合回路。错误。D. 根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的水电离产生的H+应该在阴极放电,产生H2。反应的电极方程式为:2H2O +2e-= H2↑+ 2OH-。正确。
本题难度:一般
2、选择题 下图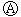 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是(?)
后,使c、d两点短路.下列叙述正确的是(?)
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为铜板
D.e极发生还原反应
参考答案:B
本题解析:略
本题难度:简单
3、选择题 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。

已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是? ( )。
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束时,右侧溶液中含IO3—
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑
KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
参考答案:D
本题解析:左侧变蓝,说明左侧是阳极,I-在阳极放电,被氧化生成I2,因而右侧是阴极,只能是水电离的H+放电被还原生成H2,其电极反应为2H2O+
2e-=H2↑+2OH-,A项正确;阴离子交换膜允许阴离子通过,B项正确;电解KI的过程发生如下两个反应:
①2I-+2H2O I2+2OH-+H2↑
I2+2OH-+H2↑
②3I2+6OH-=IO3—+5I-+3H2O
①×3+②即得总方程式,C项正确;如果将阴离子交换膜换成阳离子交换膜,阴极产生的OH-将不能到达阳极区,I2与OH-无法反应生成IO3—,因而D项错。
本题难度:一般
4、选择题 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )
A.阴极自始至终只产生H2
B.电解过程中,溶液颜色呈现红色→紫色→蓝色的变化
C.电解过程中,Na+和SO42-的物质的量浓度保持不变
D.第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl
参考答案:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至终无法放电,且其溶液pH=7,暂时可以忽略,电极反应为:
阳极:2Cl--2e-=Cl2↑?2Cl--2e-=Cl2↑?4OH--4e-=2H2O+O2↑
?2?2? 1? 1?
阴极:2H++2e-=H2↑? 2H++2e-=H2↑? 2H++2e-=H2↑
?2? 2? 1? 1
则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl?通电?.?H2↑+Cl2↑,2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,2H2O?通电?.?2H2↑+O2↑,生成的NaOH为碱性,pH大于7;
A、阴极上始终是氢离子得到电子生成氢气,故A正确;
B、阴极电极过程产物分析,开始蓝色使石蕊变红色,随氢离子放电减小,溶液变为紫色,电解过程中生成的NaOH为碱性,pH大于7石蕊试液颜色又变为蓝色,故B正确;
C、电解过程中,Na+和SO42-的物质的量不变,但电极过程中溶剂水减少,所以物质的量浓度增大,故C错误;
D、第一阶段电解的是氯化氢,的及过程中阴、阳两极产生的气体氢气和氯气,依据电子守恒可知,混合引燃后,恰好完全反应得到HCl,故D正确;
故选C.
本题解析:
本题难度:一般
5、选择题 将质量相等的Ag片和铂片插入硝酸银溶液(足量)中,银片与电源正极相连,铂片与电源负极相连。以电流1?A通电10?min,然后反接电源,以电流2?A继续通电10?min。下图为表示银电极的质量、铂电极的质量、电解池中产生气体的质量和电解时间的关系图,正确的是
[? ]
A.
B.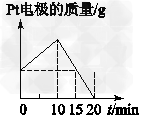
C.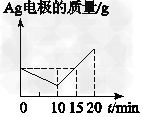
D.
参考答案:C
本题解析:
本题难度:一般