1、选择题 用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O.下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3molNa2O2发生反应,有12mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀毒
参考答案:A、反应Fe2O3+3Na2O2=2Na2FeO4+Na2O中,氧元素化合价降低,Na2O2是氧化剂,铁元素化合价升高,Fe2O3是还原剂,故A错误;
B、还原剂Fe2O3对应的产物Na2FeO4是氧化产物,氧化剂Na2O2对应的产物Na2FeO4和Na2O叫还原产物,所以Na2FeO4既是氧化产物又是还原产物,故B正确;
C、在反应Fe2O3+3Na2O2=2Na2FeO4+Na2O中,铁元素化合价共升高6价,所以反应过程转移的电子的量为6mol,消耗3molNa2O2,故C错误;
D、根据化合价规则可知在Na2FeO4中Fe为+6价,居于铁元素的最高价,具有强氧化性,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 在氧化还原反应中,下列叙述正确的是( )
A.物质在反应中失去电子,该物质是氧化剂
B.物质失去电子的反应为氧化反应
C.没有单质参加的反应一定不是氧化还原反应
D.在反应中一种物质被氧化,另一种物质一定被还原
参考答案:A.物质在反应中失去电子,该物质是还原剂,故A错误;
B.物质失去电子,为还原剂,被氧化,发生的反应为氧化反应,故B正确;
C.没有单质参加的反应可能是氧化还原反应,如二氧化硫与过氧化氢反应生成硫酸,故C错误;
D.在反应中可能同种物质被氧化,也被还原,如氯气与水反应生成HCl、HClO,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al
2Fe+Al2O3的叙述错误的是( )
A.属于置换反应
B.属于氧化反应
C.Al作还原剂
D.Fe2O3被氧化
参考答案:A.反应符合一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,为置换反应,故A正确;
B.反应中Al和Fe元素化合价发生变化,属于氧化还原反应,故B正确;
C.反应中Al元素化合价由0价升高到+3价,被氧化,Al为还原剂,故C正确;
D.Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,故D错误.
故选D.
本题解析:
本题难度:简单
4、简答题 氨气与氧化铜反应的化学方程式为:3CuO+2NH3
3Cu+N2+3H2O,完成下列填空:
(1)该反应的还原剂是______,发生还原反应的物质是______.
(2)在方程式上标出电子转移的方向和数目.______
(3)若反应中转移0.90mol电子,则生成铜的质量为______g.
参考答案:(1)Cu元素化合价由+2价降低到0价,被还原,CuO为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,故答案为:NH3;CuO;
(2)反应中Cu元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为6,电子转移的方向和数目可表示为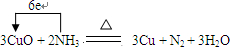 ,故答案为:
,故答案为: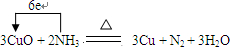 ;
;
(3)由方程式可知,转移2mol电子,则生成1molCu,则转移0.90mol电子,应生成0.45molCu,m(Cu)=0.45mol×64g/mol=28.8g,
故答案为:28.8.
本题解析:
本题难度:一般
5、填空题 实验室常用浓HCl与MnO2的反应制取少量的氯气,其化学方程式为MnO2+4HCl=MnCl2+Cl2↑+2H2O取一定量的浓盐酸与二氧化锰发生反应,产生的氯气在标况下的体积为11.2L.则反应中的氧化剂为______(填化学式),质量为______;还原剂为______(填化学式),物质的量为______;转移电子的数目为______.
参考答案:产生的氯气在标况下的体积为11.2L,其物质的量为11.2L22.4L/mol=0.5mol,
MnO2+4HCl=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,由MnO2~Cl2↑可知,其质量为0.5mol×87g/mol=43.5g,
Cl元素的化合价升高,则HCl为还原剂,由2HCl~Cl2↑可知,还原剂的物质的量为0.5mol×2=1mol,
由Cl2↑~2e-可知,转移电子数目0.5mol×2×NA=NA个,
故答案为:MnO2;43.5g;HCl;1mol;NA.
本题解析:
本题难度:一般