1、选择题 用0.10mol/L的盐酸滴定0.10mol/L的氨水,滴定过程中不可能出现的结果是
[? ]
A.c(NH4+)>c(Cl-), c(OH-) >c(H+)
B.c(NH4+) = c(Cl-), c(OH-) = c(H+)
C.c(Cl-) >c(NH4+), c(OH-) >c(H+)
D.c(Cl-) >c(NH4+), c(H+) >c(OH-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列关系式不正确的是( )
A.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后:c(CH3COOH)+c(H+)>c(OH-)
B.1L0.3mol?L-1NaOH溶液吸收标准状况下4.48LCO2:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后:c(Cl-)>c(NH4-)>c(Na+)>c(OH-)>c(H+)
D.0.1mol?L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1
参考答案:A.醋酸为弱酸,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,醋酸过量,溶液呈酸性,
则c(H+)>c(OH-),所以一定存在c(CH3COOH)+c(H+)>c(OH-),故A正确;
B.n(NaOH)=1L×0.3mol/L=0.3mol,n(CO2)=4.48L22.4L/mol=0.2mol,
二者发生:3OH-+2CO2=CO32-+HCO3-+H2O,由于CO32-水解程度大于HCO3-,且CO32-水解生成HCO3-,则c(HCO3-)>c(CO32-),故B错误;
C.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后,溶液中存在NH4+和NH3?H2O,溶液呈碱性,NH3?H2O电离程度大于水解程度NH4+,
则c(Cl-)>c(NH4-)>c(Na+)>c(OH-)>c(H+),故C正确;
D.根据物料守恒,c(Na2CO3)=0.1mol/L,而Na2CO3以CO32-、HCO3-、H2CO3等形成存在于溶液中,则c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol?L-1,故D正确.
故选B.
本题解析:
本题难度:一般
3、选择题 下列推断合理的是?
[? ]
A.在常温下,Na2SiO3+H2O+CO2?=?Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,Na2CO3+SiO2?=?Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 ?
B.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则 c[(NH4)2SO4]>c[(NH4)2CO3]?>c[(NH4)2Fe(SO4)2] ?
C.向1L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g时,则溶液中2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)]
D.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中
C.在氯化铵溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.H2SO3的电离方程式为H2SO3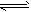 2H++SO32-
2H++SO32-
参考答案:AC
本题解析:
本题难度:一般
5、填空题 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2?xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用氧化还原滴定法测定TiO2的质量分数操作如下:首先在一定条件下,把TiO2溶解并转化为Ti3+,再用NH4Fe(SO4)2标准溶液滴定Ti3+至全部转化成Ti4+.
请回答下列问题:

(1)TiCl4水解生成TiO2?xH2O的化学方程式为______.
(2)检验TiO2?xH2O中Cl-是否被除净的方法是______.
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是______;配制溶液使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号).
(4)该滴定操作所用到的指示剂是______,滴定终点的现象是______
(5)滴定分析时,称取TiO2(摩尔质量为M?g?mol-1)试样w?g,消耗c?mol?L-1NH4Fe(SO4)2标准溶液V?mL,则TiO2质量分数为______.
参考答案:解析:(1)设TiCl4的系数为1,根据元素守恒,TiO2?xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x).故答案为:TiCl4+(x+2)H2O=TiO2?xH2O↓+4HCl;
(2)溶液中生成TiO2?xH2O沉淀,固体具有较强的吸附能力,会吸附溶液中的Cl-离子,可通过检验Cl-离子的方法检验沉淀是否被洗净,检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)铁离子易水解,配制溶液时先加一些硫酸,使溶液呈酸性,抑制NH4Fe(SO4)2水解,配制一定物质的量浓度的溶液,配制溶液使用的仪器除天平、药匙、玻璃棒、烧杯、量筒、容量瓶和胶头滴管等,故答案为:抑制NH4Fe(SO4)2水解,a?c;
(4)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3, 故答案为:KSCN溶液;溶液变为红色,且半分钟不褪色;
(5)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数为cVM1000W或cVM10W%.
故答案为:cVM1000W或cVM10W%.
本题解析:
本题难度:一般