|
高考化学知识点归纳《弱电解质电离平衡》高频考点预测(2017年最新版)(二)
2017-11-11 02:29:43
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 25 ℃时,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b
B.a>b
C.c(A-)=c(Na+)
D.c(A-)<c(Na+)
|
参考答案:C
本题解析:假如酸是强酸,则酸和碱恰好反应显中性,其物质的量应该相等,,即体积相等时,a=b;假如酸为弱酸,pH=7,酸应该过量,体积相等时,a>b;故,A、B错;要显中性,c(H+)=c(OH-),根据电荷守恒,则c(Na+)=c(A-),D错;答案选C。
本题难度:一般
2、选择题 20℃时,H2S的饱和溶液浓度约为0.1mol/L,其电离方程式为:
第一步H2S 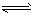 H++HS-; H++HS-;
第二步HS-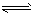 H++S2-。若要使该溶液的c(H+)增大的同时,c(S2-)减小,可采用的措施是 H++S2-。若要使该溶液的c(H+)增大的同时,c(S2-)减小,可采用的措施是
①加入适量的NaOH溶液; ②加入适量的水;③通入适量的SO2;④加入适量硫酸铜固体;
⑤加入少量盐酸
[? ]
A.①③⑤
B.②④⑤
C.②③
D.④⑤
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是(?)
A.氨水的浓度等于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1
参考答案:D
本题解析:A. 常温下,pH=11的氨水,c(H+)=10-11mol/L;c(OH-)=10-3mol/L, pH=1的盐酸, c(H+)=0.1mol/L.二者等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则c(NH3)= 0.1mol/L.正确。B.NH3·H2O NH4++ OH-。c(NH4+)= c(OH-)=10-3mol/L; c(NH3)= 0.1mol/L.所以原氨水中NH4+的含量为0.1mol/L÷10-3mol/L÷100% =1%。正确。C.氨水中水电离出的c(H+)= 10-11mol/L,盐酸中水电离出的c(H+)=c(OH-)=10-13mol/L二者的比为:10-11mol/L:10-13mol/L =100。正确。D.根据物料守恒可得:混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-2mol/L.错误。 NH4++ OH-。c(NH4+)= c(OH-)=10-3mol/L; c(NH3)= 0.1mol/L.所以原氨水中NH4+的含量为0.1mol/L÷10-3mol/L÷100% =1%。正确。C.氨水中水电离出的c(H+)= 10-11mol/L,盐酸中水电离出的c(H+)=c(OH-)=10-13mol/L二者的比为:10-11mol/L:10-13mol/L =100。正确。D.根据物料守恒可得:混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-2mol/L.错误。
本题难度:一般
4、选择题 下列解释实验事实的方程式不正确的是( )
A.0.1mol/LCH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)(红棕色)?N2O4(g)(无色)△H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-?3Fe2++2NO2+4H2O
D.向Na2CO3溶液中滴入酚酞,溶液变红:CO32-+H2O?HCO3-+OH-
参考答案:A、0.1mol/LCH3COOH溶液的pH>1,则醋酸电离生成的氢离子的浓度小于0.1mol/L,即醋酸为弱电解质,其电离方程式为CH3COOH CH3COO-+H+,故A正确; CH3COO-+H+,故A正确;
B、因2NO2(g)(红棕色) N2O4(g)(无色)△H<0,该反应为放热反应,在冷水中该反应向正反应方向移动,则颜色变浅,故B正确; N2O4(g)(无色)△H<0,该反应为放热反应,在冷水中该反应向正反应方向移动,则颜色变浅,故B正确;
C、铁溶于稀硝酸,溶液变黄,铁被氧化为三价铁离子,离子反应为Fe+4H++NO3- Fe3++NO↑+2H2O,故C错误; Fe3++NO↑+2H2O,故C错误;
D、因碳酸根离子水解使碳酸钠溶液显碱性,CO32-+H2O HCO3-+OH-,故向Na2CO3溶液中滴入酚酞,溶液变红,故D正确; HCO3-+OH-,故向Na2CO3溶液中滴入酚酞,溶液变红,故D正确;
故选C.
本题解析:
本题难度:简单
5、选择题 常温下,下列有关物质的量浓度关系正确的是(?)
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)
D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-)
参考答案:B
本题解析:HCl是强酸,醋酸是弱酸,等浓度的两种酸氢离子的浓度前者大,因此对水电离的抑制作用较大,因此水电离出的c(H+):HCl<CH3COOH ,A错误;根据越弱越水解的原理,等浓度时碳酸钠的水解程度大于碳酸氢钠,因此若pH相同,则c(Na2CO3)<c(NaHCO3),B正确;C中式子不满足电荷守恒和物料守恒式,C错误;HS-离子发生水解,所以c(Na+)>c(HS-),D错误;故选B。
本题难度:一般
|