1、选择题 下列事实不能证明亚硝酸是弱电解质的是? (? )
A.NaNO2在水溶液中完全电离
B.HNO2能使石蕊试液变红
C.等物质的量浓度的HNO2的导电能力比盐酸弱
D.0.1mol/L的HNO2溶液的PH为2
参考答案:AB
本题解析:只要说明亚硝酸是部分电离的即可。A中只能说明NaNO2是强电解质;B中只能说明HNO2电离,并不能说明HNO2是部分电离;而C中说明HNO2中自由离子浓度少,说明HNO2是部分电离;D中0.1mol/L的HNO2溶液中[H+]为0.01mol/L,说明HNO2是部分电离。
本题难度:简单
2、选择题 在H2S的饱和溶液中存在下列平衡? ①H2S H++HS-②HS-
H++HS-②HS- H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是(?)
H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是(?)
A.加NaOH
B.通入H2S气体
C.降温
D.加入Na2S晶体
参考答案:D
本题解析:考查弱电解质的电离平衡的移动:它受酸、碱、盐、浓度及温度的影响。
A.加NaOH时,OH—消耗溶液中的H+,平衡右移,排除
B.原溶液已经饱和,通入H2S气体,对原平衡及微粒浓度没有影响,排除
C.电离平衡是吸热反应,降温时平衡左移,溶液中的c(S2-)减小,排除
D.加入Na2S晶体,c(S2-)增大,平衡左移,c(H+)减小,pH升高,符合题意
故答案为D
本题难度:简单
3、简答题 相同温度下的0.1摩/升和0.01摩/升CH3COOH溶液中,CH3COOH的电离度( )
A.大于
B.小于
C.等于
D.不能肯定
参考答案:相同温度下的0.1摩/升和0.01摩/升CH3COOH溶液,
0.1mol/L>0.01mol/L,
由浓度越小,电离程度越大,
则0.01摩/升CH3COOH溶液中CH3COOH的电离度大,
故选B.
本题解析:
本题难度:一般
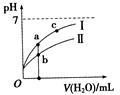
4、选择题 已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是
CH3COOH
| HClO
| H2CO3
|
Ka=1.8×10-5
| Ka=3.0×10-8
| Ka1=4.4×10-7?Ka2=4.7×10-11
|
?
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
参考答案:C
本题解析:A、醋酸的酸性强于次氯酸,所以相同浓度的CH3COONa和NaClO的混合溶液中,水解程度CH3COO-< ClO—,溶液中离子浓度的大小关系是C(Na+)>C(CH3COO—) >C(ClO—) >C(OH—)>C(H+),错误;B、由所给电离平衡常数可知酸性H2CO3> HClO> HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO—+CO2+H2O=HClO+HCO3—,错误;C、a、b、c三点所示溶液中氢离子浓度的大小关系是b>a>c,氢离子浓度越大,使水的电离平衡逆向移动,水的电离程度越小,所以水的电离程度c>a>b,正确;D、醋酸的酸性比次氯酸强,所以加入相同体积的水时醋酸的pH小于次氯酸,所以Ⅰ表示HClO,Ⅱ表示CH3COOH,溶液的导电性与溶液中的离子浓度有关,离子浓度越大,导电性越强,所以溶液导电性: b>a>c,错误,答案选C,
本题难度:一般
5、选择题 下列说法正确的是
A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8
B.给稀醋酸溶液加热,溶液pH值增大
C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍
D.在H2CO3溶液中,C(H+) :C(CO32—-)=2∶1
参考答案:C
本题解析:略
本题难度:简单