1、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________。
(2)另取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后收集到气体Y。
甲同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为______。
【探究二】
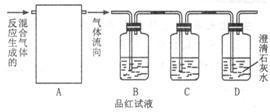
分析上述实验中SO2体积分数的结果,乙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是_________________________________________。
(4)认为气体Y中还含有Q的理由是______________________________。(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于______(选填序号)。
a.A之前? b.A、B间? c.B、C间? d.C、D间
(6)如果气体Y中含有H2,预计实验现象应是____________________________。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28 mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由________。
参考答案:(1)铁钉表面被钝化
(2)66.7%
(3)检验SO2是否除尽
(4)C+2H2SO4(浓)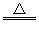 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)c?(6)D中固体由黑变红和E中固体由白变蓝
本题解析:(7)否,用托盘天平无法称量D或E的差量(或可以,可用分析天平称量D或E的差量)(1)铁钉在浓硫酸中发生钝化,表面生成一层致密的氧化膜。
(2)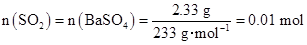 ,所以V(SO2)="0.01" mol×
,所以V(SO2)="0.01" mol×
22.4 L·mol-1="0.224" L="224" mL,SO2体积分数为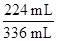 ×100%≈66.7%。
×100%≈66.7%。
(3)铁钉为碳素钢,故加热后碳与浓硫酸反应可产生CO2、SO2,当浓硫酸变稀后,会产生H2,所以混合气体中有SO2、CO2、H2。能对品红溶液产生作用的只有SO2,所以品红溶液的作用是检验SO2是否在前一洗气瓶中被除尽。
(5)检验CO2要用澄清石灰水,应放在SO2被除尽之后进行,因SO2与澄清石灰水也可出现浑浊现象;也不能放在C、D之间,因为气体会带出水蒸气,对后面实验结果带来影响,且碱石灰能吸收CO2,故M应放于B、C之间。
(6)H2还原CuO(黑色)得Cu(红色),生成的水被无水CuSO4吸收生成蓝色的CuSO4·5H2O。
(7)由于H2量很少,微小质量变化用托盘天平无法测量,只能用更精密的分析天平称量。
本题难度:一般
2、填空题 浓硫酸和碳在加热的情况下反应的化学方程式为C+2H2SO4=CO2↑+2SO2↑+2H2O为了验证反应的各种生成物,用如图Ⅰ装置进行实验。
图Ⅰ
(1)图Ⅰ中A处是完成实验中的必要装置,它是下列图Ⅱ所示中的(填编号)_________;
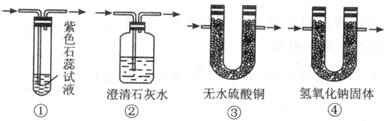
图 Ⅱ
(2)C装置中应盛的试剂为足够_______________,其作用__________;
(3)能够确定存在二氧化碳气体的实验现象_______________________。
参考答案:(6分)(1)__③__;(2)_酸性高锰酸钾__,
?
除去二氧化硫气体_(2分);(3)D中_澄清石灰水变浑浊。(2分)
本题解析:略
本题难度:一般
3、实验题 长期存放的亚硫酸钠可能会被氧化,某化学课外活动小组现通过实验来确定某无水亚硫酸钠变质,并测定亚硫酸钠的纯度。
Ⅰ.有三位学生各取少量样品设计了下述三个实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42?-离子。你认为合理的方案有?。
方案甲:试液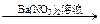 白色沉淀
白色沉淀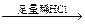 白色沉淀。
白色沉淀。
方案乙:试液 有无色气体生成
有无色气体生成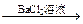 白色沉淀。
白色沉淀。
方案丙:试液 无色溶液
无色溶液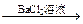 白色沉淀。
白色沉淀。
Ⅱ.同学丁取35g该样品,加入800mL某浓度的盐酸,加热使生成的气体全部逸出,所得气体用氨水吸收,溶液增重16g。然后向原溶液中逐滴加入0.5mol/L的Ba(OH)2溶液500mL。有沉淀生成,此时溶液呈中性。
(1)用氨水吸收气体发生反应的可能的离子方程式?
?。
(2)样品中Na2SO3的纯度是?,盐酸的物质的量浓度________________。
参考答案:(共8分) Ⅰ.乙(2分)
Ⅱ.(1)2NH3·H2O+SO2(少量)=2NH4++SO32-+H2O? NH3·H2O+SO2(过量)=NH4++HSO3-(各1分)
(2)90﹪(2分)? (3)1.25mol/L(2分)
本题解析:略
本题难度:简单
4、选择题 用如图所示实验装置进行物质性质的探究实验。下列说法不合理的是(?)

A.若品红溶液①褪色,则说明产物中含有SO2
B.若溴水褪色,则说明SO2具有还原性
C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只作氧化剂
D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明亚硫酸比碳酸的酸性强
参考答案:C
本题解析:A项,SO2能使品红溶液褪色;B项,SO2使溴水褪色表现还原性;C项烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3既作氧化剂又作还原剂;D项品红溶液②不褪色说明没有SO2,Na2SiO3溶液中出现白色浑浊说明有CO2,依据强酸制弱酸原理说明亚硫酸比碳酸的酸性强。
本题难度:一般
5、选择题 取11.2 g铁粉和4.8 g硫粉均匀混合加热至红热,冷却后加足量盐酸,在标准状况下能收集到的气体体积为(? )
A.4.48 L
B.3.36 L
C.2.24 L
D.1.12 L
参考答案:A
本题解析:11.2 g铁粉即为0.2 mol,4.8 g S即为0.15 mol,根据Fe+S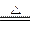 FeS可以判断Fe过剩,因此,将反应后所得物质与盐酸反应收集到的气体,既有FeS与盐酸反应生成的H2S,又有剩余的Fe与盐酸反应生成的H2。根据反应FeS+2HCl====FeCl2+H2S↑和Fe+2HC l====FeCl2+H2↑,可知最后所得气体的物质的量只与最初的铁粉的量有关,而与硫粉的量无关,即0.2 mol Fe发生反应可生成0.2 mol气体。
FeS可以判断Fe过剩,因此,将反应后所得物质与盐酸反应收集到的气体,既有FeS与盐酸反应生成的H2S,又有剩余的Fe与盐酸反应生成的H2。根据反应FeS+2HCl====FeCl2+H2S↑和Fe+2HC l====FeCl2+H2↑,可知最后所得气体的物质的量只与最初的铁粉的量有关,而与硫粉的量无关,即0.2 mol Fe发生反应可生成0.2 mol气体。
本题难度:简单