1、计算题 稀盐酸和稀硫酸的混合溶液200 mL,加入3.42g Ba(OH)2粉末恰好完全中和。过滤、洗涤、干燥,得固体2.33g。则原混合酸中
(1)c(H2SO4)=____________,
(2)c(HCl)=______________,
(3)c(H+)=_______________。(设溶液的总体积不变)
参考答案:(1)c(H2SO4)=0.05mol/L
(2)c(HCl)=0.1mol/L
(3)c(H+)=0.2mol/L
本题解析:
本题难度:一般
2、选择题 MgCl2溶液与Na2SO4溶液混合后,c(Mg2+)=c(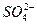 ),则下列说法不正确的是(?)
),则下列说法不正确的是(?)
A.混合液中c(Cl-)=c(Na+)
B.混合液中c(Cl-)=2c(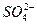 )
)
C.混合前两溶液体积相等
D.混合前两溶液中MgCl2与Na2SO4物质的量相等
参考答案:C
本题解析:根据溶液电荷守恒,c(Na+)+2×c(Mg2+)=c(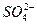 )×2+c(Cl-),又因为?c(Mg2+)=c(
)×2+c(Cl-),又因为?c(Mg2+)=c(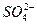 ),所以A正确。因为2c(Mg2+)=c(Cl-),又因为c(Mg2+)=c(
),所以A正确。因为2c(Mg2+)=c(Cl-),又因为c(Mg2+)=c(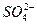 ),所以B正确。混合后为同一溶液,体积相等,浓度相同,必然物质的量相同,所以D正确。
),所以B正确。混合后为同一溶液,体积相等,浓度相同,必然物质的量相同,所以D正确。
本题难度:简单
3、实验题 下图为配制250 mL 0.2 mol/L Na2CO3溶液过程的示意图。
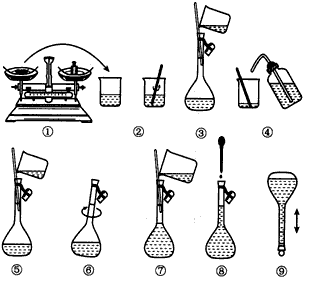
回答下列问题:
(1)①中称得Na2CO3____g。
(2)玻璃棒在②③两步中的作用分别是______________、_______________
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤___________;
C.在第⑤步不慎有少量液体流到容量瓶外___________。
参考答案:(1)5.3
(2)搅拌;引流
(3)偏高;偏低;偏低
本题解析:
本题难度:一般
4、填空题 (10分)(1)1molO2与1molO3分子数之比为?,原子数之比为?
(2)含有O原子物质的量相同的SO2与SO3,分子数之比为?,所含的S原子数之比为?,所含的原子总数之比为?
参考答案:(10分)(1)1:1, 2:3(2)3:2, 3:2,9:8
本题解析:(1)根据阿伏加德罗定律可知,1molO2与1molO3分子数之比为1︰1。根据单质的组成可知,原子数之比是2︰3。
(2)设二氧化硫和三氧化硫的物质的量分别是a和b,则依据题意可知2a=3b,所以a︰b=3︰2,则分子式之比就是3︰2。根据化合物的组成可知,所含的S原子数之比为3︰2,所含的原子总数之比为9︰8。
点评:在利用物质的物质的量计算原子数时,首先要分析组成该物质的原子个数,然后在列式计算。且不能把原子数和分子数混为一谈。
本题难度:一般
5、填空题 (14分)(1)284g Na2SO4中所含的Na2SO4物质的量是?,Na+的物质的量是?。1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是?则R的相对原子质量是?。
(2)有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是________,B是________, C是________。?
参考答案:(1)2mol;4mol;120g/mol;24。(2)BaCl2? K2CO3? Na2SO4
本题解析:考查物质的量的有关计算及离子的检验。
(1)硫酸钠的摩尔质量是142g/mol,所以根据n=m/M可知,284g硫酸钠的物质的量是284g÷142g/mol=2mol,其中钠离子的物质的量是2mol×2=4mol;1.2gRSO4中含0.01molR2+,则RSO4的物质的量也是0.01mol,因此该化合物的摩尔质量是1.2g÷0.01mol=120g/mol。R的相对原子质量是120-32-16×4=24。
(2)能和硫酸反应生成白色沉淀的是氯化钡,所以A是氯化钡;碳酸钾能和稀硫酸反应生成CO2气体,所以B是碳酸钾;硫酸钠和稀硫酸不反应,所以C是硫酸钠。
本题难度:一般