1、选择题 某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀.对样品所含杂质判断完全正确的是( )
A.肯定有KNO3
B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列实验数据记录和实验方法正确的是
[? ]
A.用天平称取4.0 g NaOH固体,用100 mL量筒配制1.00 mol/L的NaOH溶液
B.用25 mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液22. 32 mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500 mL NO2气体,求得NO2气体的物质的量为(0. 5/22.4) mol
参考答案:B
本题解析:
本题难度:一般
3、简答题 食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液?NaOH溶液?BaCl2溶液?Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为______(只填化学式).
②过滤之前,怎样检验SO42-已除去:______.
③过滤所需要的玻璃仪器有______.
④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是______.
(2)用提纯的NaCl配制250mL?2.00mol-L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有______(填仪器名称).
②计算后,需称出NaOH质量为______g.
③下列操作的正确顺序是(用字母表示)______.
A.摇匀?B.称量?C.洗涤?D.定容?E.溶解?F.移液?G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A?定容时仰视容量瓶刻度线:______.B?称量时砝码生锈:______.
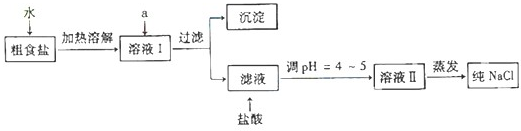
参考答案:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+,故答案为:BaCl2、NaOH、Na2CO3;
②取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全,故答案为:取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全;
③过滤装置需要用到的玻璃仪器是漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
④先用盐酸调pH再过滤,生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,过滤后不能提纯氯化钠;
故答案为:生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度;
(2)①用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液,需要的仪器有烧杯,玻璃棒、250ml容量瓶、胶头滴管、托盘天平;其中烧杯、玻璃棒是上述实验用到,还需要250ml容量瓶、胶头滴管、托盘天平;故答案为:250ml容量瓶、胶头滴管、托盘天平;
②配制250mL 2.00mol?L-1NaCl溶液中溶质物质的量=0.25L×2.00mol/L=0.5mol,氯化钠质量=0.5mol×58.5g/mol=29.25g;但托盘天平只能称量到0.1g,所以需要称量氯化钠质量29.3g,
故答案为:29.3;
③溶液配制步骤是计算、称量、溶解、转移、洗涤转移,加水定容、摇匀、装瓶;所以操作的正确顺序是B→E→F→C→D→A→G,故答案为;B→E→F→C→D→A→G;
④A、定容时仰视容量瓶刻度线,分析依据是刻度定液面,仰视加水超过刻度线,浓度偏低;故答案为:偏低;
B、称量时砝码生锈,砝码质量增大,称量氯化钠质量增大,结果偏高;故答案为:偏高.
本题解析:
本题难度:一般
4、选择题 下列实验合理的是
A.配置一定浓度硫酸
B.制备少量氨气
C.制备少量二氧化氮其他
D.制备少量氧气
参考答案:B
本题解析:分析:A、浓硫酸溶于水会使溶液温度升高,容量瓶不能做稀释溶液的容器;
B、氧化钙和水反应生成氢氧化钙放热,使氨水分解生成氨气;
C、二氧化氮气体通入水中 会和水反应生成硝酸和一氧化氮;
D、过氧化钠和水剧烈反应,不能起到随时反应随时停止的原理.
解答:A、配置一定浓度硫酸,浓硫酸溶于水溶液温度升高,所以应在烧杯中溶解浓硫酸,冷却后再转入容量瓶,容量瓶不能用来稀释溶解物质,故A错误;
B、氨水滴入氧化钙,氧化钙和水反应放热,使氨水分解生成氨气,可以制备少量氨气,故B正确;
C、二氧化氮不能用排水法收集,因为二氧化氮与水反应生成硝酸和一氧化氮,故C错误;
D、过氧化钠和水剧烈反应,能快速制的氧气,但不能起到随时反应、随时停止的装置反应原理的要求,故D错误;
故选B.
点评:本题考查了常见气体的制备方法,装置、试剂的选择,溶液配制的注意问题,掌握实验基本操作是解题关键.
本题难度:困难
5、简答题 为了用实验的方法验证镁和铁的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铁与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铁与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案______
(2)学生乙在实验中取了一段镁条,投入稀盐酸中,现象不是十分明显,请分析原因______.
(3)学生丙另辟蹊径,仅用镁条、铁片与盐酸只进行一次实验也得出正确的结论(其它用品自选),学生丙用的是什么方法?______简述现象______.
参考答案:(1)常温下金属镁和水的反应不是很剧烈,金属铁和水不反应,但是二者均可以和盐酸反应,并且金属镁和酸反应产生氢气的速率快,剧烈,而金属铝不如镁剧烈,故答案为:方案二;
(2)在金属镁条的表面会生成一层致密的氧化物薄膜,阻止一些反应的进行,这样导致镁条投入稀盐酸中,现象不是十分明显,故答案为:镁的表面存在氧化膜;
(3)原电池中负极金属的活泼性一般是强于正极金属的活泼性的,这样让金属镁和铁做电极,让盐酸作电解质,会在金属铁电极表面产生气泡,所以金属铝是正极,镁条溶解,镁是负极,活泼性:金属镁强于金属铝,
故答案为:构成原电池的方法;镁条溶解,铁的表面有气泡.
本题解析:
本题难度:一般