1、选择题 用下列有关实验装置进行相应实验,能达到实验目的是( )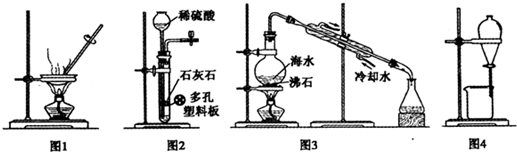
A.用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体
B.用图2装置制取二氧化碳气体
C.用图3装置蒸馏海水制取少量淡水
D.用图4装置分离乙醇与乙酸乙酯的混合物
参考答案:C
本题解析:
本题难度:简单
2、简答题 工业上对海水资源综合开发利用的部分工艺流程如图1所示.

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na2CO3溶液后相关化学反应的离子方程式:______.
(2)本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?______(填“能”或“否”),原因是______.
(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是______.
A.Cl-?B.Na+?C.OH-?D.Cl2
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:

①上述生产纯碱的方法称______,副产品的一种用途为______.
写出上述流程中X物质的分子式______.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是______.
②合成氨原料气中氮气制备的方法之一为______,另一原料气氢气的制取化学方程式为______.
③沉淀池中发生的化学反应方程式是______.要实现该反应,你认为应该如何操作:______;
④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加______.
参考答案:(1)Na2CO3可以把过量的钡离子转化为沉淀:Ba2++CO32-=BaCO3↓,Na2CO3可以和钙离子结合生成沉淀:Ca2++CO32-=CaCO3↓;
故答案为:Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
(2)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯.
故答案为:否.如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(3)电解饱和食盐水,用石墨做电极,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,
故答案为:B;
(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为溶液中氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极和电源负极相连,溶液中氢离子得到电子生成氢气,破坏了阴极附近水的电离平衡,氢氧根离子浓度增大;与电源负极相连的电极附近溶液PH增大;
故答案为:2Cl--2e-=Cl2↑;增大;
(5)①目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我国侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,得到碳酸氢钠同时得到氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用;因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环;分离沉淀的方法是过滤.
故答案为:联合制碱法,做化肥;CO2;I; 过滤
②合成氨原料气中氮气制备的方法之一是分离液态空气方法分离得到氮气,氢气用碳和水蒸气反应生成;反应化学方程式为:C+H2O?高温?.?CO+H2,CO+H2O?高温?.?CO2+H2;
故答案为:液体空气分离方法,C+H2O?高温?.?CO+H2,CO+H2O?高温?.?CO2+H2;
③从流程图可以看出,沉淀池中加入的反应物有氨气、二氧化碳、氯化钠,根据生成物是碳酸氢钠,可推出反应物有水,同时可知碳酸氢钠为沉淀.
反应原理首先是氨气、二氧化碳和水反应生成碳酸氢氨,然后碳酸氢氨和氯化钠发生复分解反应交换成分生成碳酸氢钠晶体和氯化铵.为增大二氧化碳的吸收,应先向饱和氯化钠饱和溶液中通入氨气,再通入二氧化碳;
故答案为:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓;向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体;
④检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:用硝酸酸化的硝酸银,观察产生白色沉淀;
本题解析:
本题难度:一般
3、简答题 某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.为此,他们设计了如下装置验证所产生的气体.

(1)填写装置的作用:B______,C______,G______.
(2)先点燃______处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作______.
(3)证明有SO2生成的现象是______.
(4)可以证明气体X中含有氢气的实验现象是:______.如果去掉装置D,还能否根据F中的现象判断气体中有氢气?______(填“能”或“不能”),原因是______.
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是______.
参考答案:(1)熄灭A装置中酒精灯时,A装置中气体冷却压强减小,C装置中溶液易进入A试管中产生倒吸现象,所以B装置的作用是防止倒吸;酸性高锰酸钾溶液有强氧化性,二氧化硫能和酸性高锰酸钾溶液发生氧化还原反应而使其褪色,所以酸性高锰酸钾的作用是:验证有SO2生成,同时除去SO2;空气中含有水蒸气,如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,
故答案为:防止倒吸;验证有SO2生成,同时除去SO2;防止空气中的H2O进入F;
(2)A装置的目的是制取气体,E装置的目的是检验生成的气体,所以先点燃A处酒精灯;氢气是可燃性气体,在一定范围内易产生爆炸,为防止安全事故产生所以点燃E处酒精灯前一步操作是:检验氢气的纯度,
故答案为:A;检验氢气的纯度;?
(3)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液颜色变浅,
故答案为:酸性高锰酸钾溶液颜色变浅;
(4)生成的气体经洗气和干燥后剩余的气体就是氢气,氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,所以证明含有氢气的现象是:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;制取的气体中含有水蒸气,如果去掉D装置,会干扰H2的检验,所以不能,
故答案为:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;不能;因为混合气体中可能含H2O,会干扰H2的检验;
(5)酸性高锰酸钾有强氧化性,能氧化二氧化硫而使其褪色,所以检验亚铁离子的方法是:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+,
故答案为:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+.
本题解析:
本题难度:一般
4、简答题 某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因?.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol?L-1?KSCN溶液;0.1mol?L-1?KI溶液;0.2mol?L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式
第一步
取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液.
?
?
第二步
?
若溶液紫色褪去,则溶液含有Fe2+;
若无明显变化,则不含Fe3+.
?
|
探究二?为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用:?.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由.?.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol?L-1酸性KMnO4溶液滴定,消耗20mL?KMnO4溶液.则气体Y中NO、NO2的体积比为?.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
参考答案:
本题解析:
本题难度:一般
5、选择题 向装有碘水的试管中加CCl4振荡,静置后,你观察到的现象是
[? ]
A.上层几乎无色,下层紫红色
B.上层紫红色,下层几乎无色
C.上层几乎无色,下层橙色
D.不分层,紫红色
参考答案:A
本题解析:
本题难度:简单