|
高考化学知识点总结《无机非金属材料》在线测试(2017年最新版)(二)
2017-11-11 02:38:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 [化学—选修2化学与技术](15分)
(1)下列关于工业生产说法正确的是?。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
| E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
pH
| Ca2+?、Mg2+总浓度
| 细菌总数
| 6.5~8.5
| < 0.004 5 mol·L-1?
| <100个·mL-1?
|
以下是原水处理成自来水的工艺流程示意图:

①原水中含Ca2+?、Mg2+?、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):?;?。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成?沉淀;通入二氧化碳的目的是?和?。
③气体A的作用是?,通常可以用Ca(ClO)2替代A,下列物质中?同样可以作为气体A的代用品(填编号,多选倒扣)。
a.ClO2 ?b.浓氨水? c.K2FeO4? d.SO2
参考答案:(15分)
(1)BC?(2分)
(2)①HCO3-+OH-= CO32-+H2O? Mg2++2OH-=Mg(OH)2↓? HCO3-+Ca2++OH-= CaCO3↓+H2O(每空2分)
②胶状Fe(OH)3?(1分)除去Ca2+;?调节pH(每空2分)
③杀菌消毒;(2分)? ac(2分)
本题解析:(1)A、侯氏制碱法中先通氨气再通二氧化碳,目的是增大二氧化碳的溶解度,生成碳酸氢钠的沉淀,错误;B、硫酸工业中二氧化硫转化为三氧化硫、合成氨工业中氮气与氢气的化合反应都是可逆反应,反应物不能全部转化为生成物,所以需要循环操作,提高原料利用率,硝酸工业中尾气中仍含有一氧化氮,所以需要循环操作,提高原料利用率,正确;C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室,防止生成的氯气与氢氧化钠反应,正确;D、氯化铝是分子晶体,熔融状态下不导电,不能制取铝,错误;E、石油裂化属于化学变化,主要目的是为了获得短链的烷烃和烯烃,不一定是气态不饱和烃,错误,答案选BC;
(2)①Ca2+?、Mg2+?、HCO3-均可与氢氧化钠溶液发生反应,离子方程式为HCO3-+OH-= CO32-+H2O? Mg2++2OH-=Mg(OH)2↓? HCO3-+Ca2++OH-= CaCO3↓+H2O
②FeSO4·7H2O是常用的凝聚剂,在水中发生水解反应生成氢氧化亚铁继而被氧化成氢氧化铁的胶状沉淀,具有吸附作用,作凝聚剂;加入石灰使原水呈碱性,不符合饮用水的标准,所以通入二氧化碳目的是调节水的pH达到饮用标准,同时可以除去水中的钙离子,降低钙离子的浓度;
③原水经二级沉降后,再经过杀菌消毒,过滤,最终成为饮用水,所以A的作用是杀菌消毒;作为杀菌消毒的物质必须具备强氧化性的特点,所以代替A物质的只能是二氧化氯、高铁酸钾,答案选ac。
本题难度:一般
2、选择题 下列有关铁、铝的冶炼的说法中,正确的是? ( )
A.冶金工业中,金属铁的冶炼主要采用电解法
B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气
C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石
D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽
参考答案:D
本题解析:铁的冶炼采用热还原法。A错误;炼铁过程中CO作为还原剂把铁从其氧化物中还原出来,冶炼铝的过程中,阳极生成O2,阴极生成铝单质,B错误;冶炼铝的原料为Al2O3,冰晶石只是作为助熔剂,C错误;D正确。
本题难度:一般
3、选择题 广东正在建设海洋强省。下列说法不正确的是(? )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成的人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
参考答案:D
本题解析:D项中B是硼元素,硼元素是非金属元素不是金属元素。
本题难度:一般
4、选择题 下列关于一些物质的说法不正确的是?(?)
A.作为化工原料,天然气主要用于合成氨和生产甲醇等
B.浸泡过高锰酸钾溶液的硅土能保鲜果实和花朵
C.苯、乙酸和乙酸乙酯都可使溴的四氯化碳溶液褪色
D.淀粉和纤维素完全水解的产物相同
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (共12分)钛是21世纪金属。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
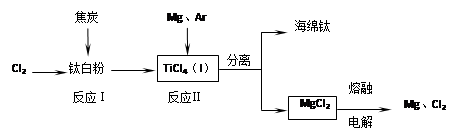
已知:① Mg(s)+Cl2 (g)=MgCl2 (s)? △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l)? △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为?。
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为?;
反应II的热化学方程式为?。
(3)该工艺流程中,可以循环使用的物质有?(填化学式)。
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的?极,阴极的电极反应式为?。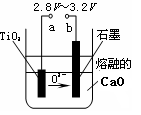
参考答案:(共12分)每空2分(1)TiO2++2H2O=H2TiO3↓+2H+(2分)
(2)TiO2+2Cl2+2C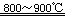
2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s)? △H=-512 kJ·mol-1(2分,状态不写0分)
(3)Mg、Cl2(每空1分,共2分)
(4)正(2分)? TiO2+4e-=Ti+2O2-(2分)
本题解析:(1)TiO2+发生水解生成钛酸(H2TiO3)沉淀,说明水解程度很大,所以TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+。
(2)根据元素的组成可知,可燃性无色气体应该是CO,所以该反应的化学方程式是TiO2+2Cl2+2C?TiCl4+2CO。根据盖斯定律可知,(①-②)×2即得到2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s),所以该反应的反应热△H=(-641kJ/mol+385 kJ/mol)×2=-512 kJ/mol。
(3)根据转化图可知,最后氯化镁电解又生成镁和氯气,二者可以循环使用。
(4)根据装置图可知,氧离子向b电极移动,所以与b相连的电极是阳极,因此b是电源的正极。电解池中阴极是得到电子的,所以阴极电极反应式是TiO2+4e-=Ti+2O2-。
点评:本题难度不是很大,考查的知识点较多、综合性较强,考查同学们新信息获取、处理及灵活运用所学知识(化学方程式、电极反应式的书写、盖斯定律以及电源正负极的判断等)进行分析问题、解决问题的能力。重点考查学生对化学知识的熟练掌握程度,以及灵活运用知识解决实际问题的能力。
本题难度:一般
| 