1、选择题 海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2
B.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质
C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向
D.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
2、填空题 (12分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
物质
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe(OH)3
| 2.2
| 3.2
|
Fe(OH)2
| 7.6
| 9.6
|
Cu(OH)2
| 4.7
| 6.4
|
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的?(填代号)。
a.? Na2O2 ?b. H2O2? c. Cl2? d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。

(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为?。
3、填空题 镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:
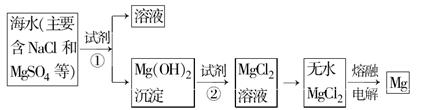
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用?。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是?。
(3)试剂②可以选用?,其反应的离子方程式为?。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式?。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为?mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为?L。
4、填空题 下面列出了复合材料与复合材料的用途。请在横线上填上对应的字母
(1)金属和碳纤维复合材料 (2)陶瓷和玻璃纤维复合材料
(3)合成树脂和玻璃纤维复合材料(4)合成树脂和碳纤维复合材料
A、球拍、钓鱼竿、赛车、冲浪板等体育用品
B、水上滑梯、运输罐、餐桌椅、排水管道等
C、飞机、火箭的机翼和机身以及导弹外壳
D、航天飞机机身上的隔热瓦
(1)__________(2)____________(3)_____________(4)___________
5、选择题 能源家族成员:①石油 ②电力 ③风能 ④天然气 ⑤水煤气 ⑥氢能, 其中属于二次能源的有
A.①③⑥
B.②④⑤
C.①③④
D.②⑤⑥