1、选择题 下列说法中,正确的是
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
参考答案:B
本题解析:A项错,氧化剂本身被还原,生成还原产物;B项正确;C项错误,还原剂在反应中化合价升高,被氧化;D项错误,同一物质,既可作还原剂,也可作氧化剂.
本题难度:简单
2、填空题 根据反应8NH3?+?3Cl2?==?6NH4Cl?+?N2?,回答下列问题:
(1)?还原剂是_________(写化学式);
(2)?用双线桥法表示该反应电子转移的方向和数目_________;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为____________升。
参考答案:(1)NH3
(2)“略”
(3)22.4
本题解析:
本题难度:简单
3、选择题 分类法是学习化学的重要方法,贯穿高中化学的始终.下列有关物质分类的依据正确的是
A.强电解质:熔融状态下是否完全电离
B.胶体:能否发生丁达尔效应
C.氧化还原反应:元素的化合价是否发生变化
D.共价化合物:是否含有共价键
参考答案:C
本题解析:分析:A.强电解质与弱电解质划分的标准是溶于水的电解质是否完全电离;
B.分散质粒子直径在1nm~100nm之间的分散系属于胶体;
C.在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应;
D.以共价键结合形成的化合物,叫做共价化合物.
解答:A.强电解质是在水溶液中或熔融状态下,能完全电离的电解质,故A错误;
B.分散质粒子直径在1nm~100nm之间的分散系属于胶体,与丁达尔效应无关,故B错误;
C.物质所含元素的化合价发生变化的反应就是氧化还原反应,故C正确;
D.离子化合物中可能含有共价键,如NaOH;也可能不含共价键.如:NaCl,故D错误.
故选C.
点评:本题考查物质的分类,难度不大,注意分散质粒子直径在1nm~100nm之间的分散系属于胶体,与丁达尔效应无关.
本题难度:困难
4、计算题 海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时若配制1000mL0.20mol/LNaOH溶液,计算称量固体NaOH的质量。
(3)取初步净化处理的浓缩海水100mL,加入200mL0.20mol/LNaOH溶液,恰好把其中的Mg2+完全沉淀,求浓缩海水中Mg2+的物质的量浓度为多少。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2多少升?
参考答案:(1)w(NaOH) =0.20mol/L×1L×40g/mol=8g?
(2)c(Mg2+) =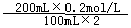 = 0.2mol/L?
= 0.2mol/L?
(3)V(Cl2)=0.02mol/L×0.1L×22.4L/mol=0.448L
本题解析:
本题难度:一般
5、选择题 4mL?0.5mol/L的某KXO4溶液恰好能将160mL?0.1mol/L的FeSO4的酸性溶液反应完全,则X元素在还原产物中的化合价为( )
A.-1
B.0
C.+2
D.+3
参考答案:n(KXO4)=0.004L×0.4mol/L=0.002mol,n(FeSO4)=0.16L×0.1mol/L=0.016mol,
反应后Fe2+被氧化为Fe3+,化合价升高1价,涉及反应后X的化合价为n,则0.002mol×(7-x)=0.016mol×1,
则x=-1,
故选A.
本题解析:
本题难度:一般