1、选择题 下列性质适合于离子晶体的是
[? ]
A.熔点1037℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点1128℃,沸点444.5℃
D.熔点97.81℃,质软,导电,密度0.97 g/cm3
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列物质中,既含极性键又含配位键的离子晶体是
[? ]
A.Ba(OH)2
B.H2SO4
C.(NH4)2SO4
D.CaF2
参考答案:C
本题解析:
本题难度:简单
3、选择题 下表是几种碳酸盐的分解温度和阳离子半径,分析下表可以得出
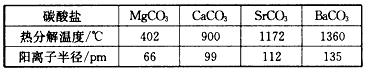
[? ]
A.离子晶体中阳离子的半径越大,越易分解
B.离子晶体中阳离子的半径越小,越易分解
C.离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易
D.离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易
参考答案:BD
本题解析:
本题难度:简单
4、填空题 在下列物质中:①NaOH、②H2O2、 ③(NH4)2S、④Na2O2、⑤C2H2、⑥SiC晶体 ⑦Na2S ⑧单晶硅。
(1)其中含有极性共价键的原子晶体是________________;
(2)其中只含有离子键的离子晶体是________________;
(3)其中既含有离子键又含有非极性共价键的离子晶体是________________;
(4)其中既含有离子键,又含有极性共价键和配位键的离子晶体是________________;
(5)其中含有极性共价键和非极性共价键的非极性分子是________________;
(6)其中含有极性共价键和非极性共价键的极性分子是________________。
参考答案:(1)⑥
(2)⑦
(3)④
(4)③
(5)⑤
(6)②
本题解析:
本题难度:一般
5、填空题 (三选一)【选修3:物质结构与性质】
有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。
(1)基态Z原子的价层电子排布式为________;XY3-离子的空间构型为________。
(2)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO______FeO(填“”?);ZO晶体中Z2+的配位数为___________。
(3)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+ 反应可生成鲜红色沉淀,其结构如图所示:
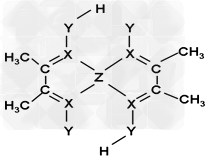
①0.5mol化合物A?中含σ键数为_______;鲜红色沉淀中X与Z2+离子间形成的是配位键,在图上标出配位键的电子给予的方向。
②该结构中,Y原子与氢原子除了形成共价键外,还存在_______作用;该结构中,碳原子的杂化轨道类型有_____。
参考答案:(1)3d84s2;平面三角形
(2)?>;6
(3)①7×6.02×1023?;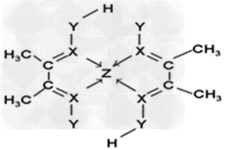 ②氢键;sp2、sp3
②氢键;sp2、sp3
本题解析:
本题难度:一般