1、选择题 下列溶液中溶质的物质的量浓度为1mol?L-1的是( )
A.将40gNaOH溶解于1L水中配成的NaOH溶液
B.常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液
C.将1L10mol/L的浓盐酸与9L水混合配成溶液
D.从1000mL1mol/LNaCl溶液中取出100mL的溶液
参考答案:D
本题解析:
本题难度:一般
2、填空题 (1)常温下,将20.0g?14%的NaCl溶液跟30.0g?24%的NaCl溶液混合,混合后得到密度为1.17g?cm-3的溶液.请计算:
①混合后的溶液中NaCl的质量分数?.②混合后的溶液中NaCl的物质的量浓度?mol/L.
③在100mL的容量瓶中需加入?mol氯化钠配制溶液,才能使其浓度恰好与上述混合后的溶液的浓度相等.
(2)在标准状况下,将672L的NH3溶解于水,配成2L的溶液,该溶液的溶质的物质的量浓度是?mol/L.
参考答案:(1)①混合液的质量分数=m1W1+m2W2m1+m2×100%=20.0g?×14%+30.0g?×24%20.0g?+30.0g?×100%=20%
故答案为20%.
②混合液的体积=mρ=50.0g1.17g?cm-3=5117L,溶质的物质的量=20.0g?×14%+30.0g×?24%58.5g/mol=20117mol所以C=nV=20117mol5117L=4mol/L;
故答案为4mol/L;
③n=CV=4mol/L×0.1L=0.4mol,故答案为 0.4
(2)氨气的物质的量n=VVm=672L22.4L/mol=30mol,,C=nV=30mol2L=15mol/L,
故答案为:15mol/L,
本题解析:
本题难度:一般
3、填空题 硝酸具有强的氧化性,并且浓度不同,氧化能力也不同。
(1)质量分数为63%,密度为?1.5?g·cm-3的浓硝酸,其物质的量浓度为___________。
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100mL?3?mol·L-1稀硝酸,他们需要量取上述浓硝酸___________mL;如下图所示仪器,在配制过程中不需用到的是_____________(填序号)。 ? ?
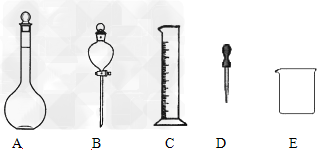
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是__________;
参考答案:(1)15?mol·L-1?
(2)20.0mL;B;玻璃棒
本题解析:
本题难度:一般
4、填空题 将10.6?g?Na2CO3溶于水配成1?L溶液
(1)该溶液中Na2CO3的物质的量浓度为________,溶液中Na+的物质的量浓度为________。
(2)向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4?mo?l/L(假设溶液体积不变)需加入NaCl的质量为________,Cl-的物质的量浓度为________。
参考答案:(1)0.1 mol/L;0.2 mol/L
(2)11.7 g;0.2 mol/L
本题解析:
本题难度:一般
5、填空题 现用18.4mol?L-1的浓H2SO4来配制250mL、0.300mol?L-1的稀H2SO4.可供选择的仪器有:
①药匙②量筒③托盘天平④玻璃棒⑤烧瓶?⑥胶头滴管⑦容量瓶⑧烧杯.
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有______(填代号).
(2)经计算,需浓H2SO4的体积为______.现有①5mL②10mL③20mL三种规格量筒,你选用的量筒是______(填代号).
参考答案:(1)配制步骤有量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,不需要的仪器有①③⑤;
故答案为:①③⑤;
(2)稀释前后溶质的物质的量,设浓H2SO4的体积为VmL,则18.4mol?L-1×VmL=0.300mol?L-1×250mL,解得V=4.1ml,选用量筒的规格为10mL,
故答案为:4.1mL;②;
本题解析:
本题难度:一般