|
高中化学知识点讲解《影响化学反应速率的因素》高频考点巩固(2017年模拟版)(八)
2017-11-11 02:53:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 同时符合下列两个图象的反应是(温度T1>T2)( )
A.N2O3(g)?NO2(g)+NO(g);△H>0
B.H2(g)+I2(g)?2HI(g);△H>0
C.3NO2(g)+H2O(l)?2HNO3(l)+NO(g);△H<0
D.4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H<0
| 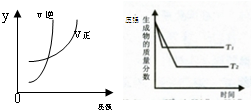
参考答案:A、可逆反应N2O3(g)?NO2(g)+NO(g)△H>0,正反应为吸热反应,且正反应为气体物质的量增大,增大移动平衡线逆反应移动,符合图象变化,故A正确;
B、可逆反应H2(g)+I2(g)?2HI(g)△H>0,正反应为吸热反应,但反应前后气体的物质的量不变,压强增大平衡不移动,不符合图象变化,故B错误;
C、可逆反应3NO2(g)+H2O(l)?2HNO3(l)+NO(g)△H<0,正反应为放热反应,正反应为气体物质的量减小,故C错误;
D、可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,正反应为放热反应,正反应为气体物质的量增大,不符合可逆反应特征,故D错误.
故选A.
本题解析:
本题难度:简单
2、实验题 (8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
实验编号
| 锌的状态
| 反应温度/℃
| 收集100mL氢气所需时间
| ①
| 薄片
| 15
| 200
| ②
| 薄片
| 25
| 90
| ③
| 粉末
| 25
| 10
|
(1)该实验的目的是研究??、?对锌和稀盐酸反应速率的影响。
(2)实验①和②表明??;
(3)能表明固体的表面积对反应速率影响的实验编号是??和??。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条??。?
参考答案:(1)温度和固体的接触面积(固体的形状)
(2)其它条件不变时,升高温度,化学反应速率加快;?(3)②和③
(4)增加盐酸的浓度、加入少量的硫酸铜形成原电池(加入铜粉)或用粗锌
本题解析:(1)在反应中锌的固体表面积和反应的温度是不同的,所以实验的目的是研究温度和固体的接触面积对反应速率的影响的。
(2)实验①②中温度不同,温度越高,收集等条件氢气所用的时间就越少,即温度升高,反应速率加快。
(3)实验②③中温度相同,但固体的表面积是不同的。
(4)影响化学反应速率的因素除了温度和固体的接触面积之外,还可以是反应物的浓度,或者通过原电池反应来加快反应速率等。
本题难度:一般
3、选择题 下列说法正确的是:
A.一定温度下,反应MgCl2( l)=Mg(l)+ Cl2(g)的△H>0△S>0 l)=Mg(l)+ Cl2(g)的△H>0△S>0
B.Cl2在饱和食盐水中溶解度比纯水中小无法用勒夏特列原理去解释
C.对于反应2 H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
D.过程的自发性的作用是确定过程是否一定会发生
参考答案:AC
本题解析:略
本题难度:一般
4、实验题 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4
A:甲同学研究的实验报告如下表:
实验步骤
| 现象
| 结论
| ①分别取等体积的2mol/L的硫酸于试管中
②
| 反应速率镁>铁,铜不反应
| 金属的性质越活泼,反应速率越快
|
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。B:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成该实验应选用的实验药品 。该实验中不选用某浓度的硫酸,理由是 。
参考答案:(1)分别投入大小、形状相同的铜、铁、镁
(2)研究金属本身的性质与反应速率的关系 温度相同
(3)一定时间内产生气体的体积(或产生一定体积的气体所需的时间)
(4)镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4 常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同。18.4mol/LH2SO4使铁钝化
本题解析:(1)要比较不同的金属与硫酸反应的快慢时,三种金属的大小、形状相同应该是相同的,即答案应该是分别投入大小、形状相同的铜、铁、镁。
(2)由于三种金属是不同的,所以实验目的是研究金属本身的性质与反应速率的关系。比较不同的金属与硫酸反应的快慢时,处理硫酸的浓度、固体的表面积相同以外,溶液的温度应该是相同的。
(3)要比较浓度不同的硫酸与同一种金属反应的反应速率快慢,可以通过测量一定时间内产生气体的体积(或产生一定体积的气体所需的时间)。
(4)由于是比较不同浓度的硫酸与金属反应的快慢,所以选择的试剂应该是镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4。由于常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同,而18.4mol/LH2SO4使铁钝化,所以不能选择浓硫酸。
考点:考查影响化学反应速率的因素。
点评:探究性实验的一般思路
1、准确地把握实验目的。
2、利用已学知识,分析如何实现这个目的--实验原理。
3、结合实验材料,初步确定设计对策--实验方案。
本题难度:一般
5、实验题 (12分)某同学为了探究锌与硫酸反应过程中的速率变化,他在100mL稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
| 1
| 2
| 3
| 4
| 5
| 氢气体积(mL)(标准状况)
| 50
| 120
| 232
| 290
| 310
|
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大______________,原因是______________________________________________。
(2)哪一时间段的反应速率最小________________,原因是___________________。
(3)求2~3分钟时间段以硫酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)______________________________________________________。
(4)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①上述实验中涉及到的离子反应方程式有??
?;
②硫酸铜溶液可以加快氢气生成速率的原因是?;
③实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4?溶液起相似作用的是?;
④该同学通过实验进一步研究了硫酸铜的量对氢气生成速率的影响。该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
?。
参考答案:(1) 2~3min(1分),温度对反应速率影响占主导作用(1分)。
(2) 4~5min(1分),浓度对反应速率影响占主导作用(1分)。
(3) 2~3min产生的V(H2)=" 232" mL -120mL="112" mL=0.112L
n(H2)=? =0.005mol
H2SO4? ~? H2↑
1? 1?
n(H2SO4)? 0.005mol
所以n(H2SO4) =0.005mol
因此硫酸的反应速率为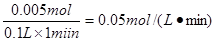 ="0.05" mol/(L?min)(2分) ="0.05" mol/(L?min)(2分)
(4)①Zn+Cu2+=Zn2++Cu(1分);Zn+2H+=Zn2++H2↑(1分)
②? CuSO4与Zn反应产生的Cu与Zn形成原电池加快了氢气产生的速率。(1分);
③? Ag2SO4(1分);
④加入一定量的 CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积(2分)。
本题解析:(1)根据表中数据可知,在0~1、1~2、2~3、3~4、4~5min内收集到的氢气分别是(ml)50、70、112、58、20。所以2~3min内反应速率最大,这是由于反应是放热反应,温度对反应速率的影响超过了浓度对反应速率的影响。
(2)4~5min内收集到的气体最少,所以反应速率最小。这是由于随着反应的进行,反应物
的浓度减小,此时浓度对反应速率的影响超过了温度对反应速率的影响。
(3)略
(4)加入硫酸铜后,新可以置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。有
关离子方程式为Zn+Cu2+=Zn2++Cu(、Zn+2H+=Zn2++H2↑。由于银的金属性也弱于锌的,所
以也能和锌构成原电池,因此与硫酸铜相似的是硫酸银。如果硫酸铜太多,则生成的单质Cu
会沉积在Zn的表面,降低了Zn与溶液的接触面积,从而降低反应速率。
本题难度:一般
| 
