1、选择题 下图表示可逆反应mA(g)+nB(g)? pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
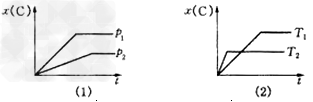
[? ]
A.放热反应,m+n>p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.吸热反应,m+n=p
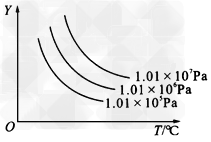
2、选择题 下图所示的是表示外界条件(温度、压强)的变化对下式反应的影响:L(s)+G(g) 2R(g)(正反应为吸热反应),在下图中,y轴是指
2R(g)(正反应为吸热反应),在下图中,y轴是指
[? ]
A.平衡时混合气体中G的百分含量 ?
B.平衡时混合气体中R的百分含量?
C.G的转化率 ?
D.L的转化率
3、选择题 一定量的气体在密闭容器中发生反应: ,平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
,平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
[? ]
A.平衡向正反应方向移动
B.物质B的转化率降低
C.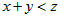
D.物质C的体积分数增大
4、填空题 Ⅰ.在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g)  ?CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
?CO(g) + H2O(g) 其平衡常数K和温度t的关系如下

(1)K的表达式为:______________;
(2)该反应的正反应为______________反应(“吸热”或“放热”);
(3)能判断该反应是否已经达到化学平衡状态的是:_______________
A.容器中压强不变
B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆
D.c(CO2) = c(CO)
(4)在850℃时,可逆反应:CO2(g) + H2(g)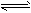 CO(g) + H2O(g),在该容器内各物质的浓度变化如下
CO(g) + H2O(g),在该容器内各物质的浓度变化如下
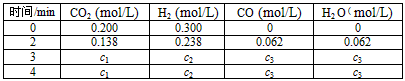
计算:3min-4min达到平衡时CO的平衡浓度c3,要求写出简单的计算过程(c3精确到小数点后面三位数)。________________________________
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应
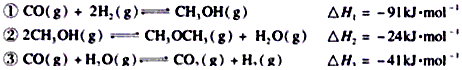
回答下列问题:
(5)新工艺的总反应为:3CO(g)+3H2(g)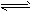 CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。
CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。
(6)增大压强,CH3OCH3的产率____________(填“增大”、“减小”或“不变”)。
(7)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。新工艺中反应③的发生提高了CH3OCH3的产率,原因是_________________________。
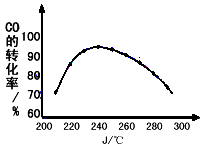
(8)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,试验结果如下图CO转化率随温度变化的规律是_________________________________,原因是_________________________。
5、填空题 ?T?℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g) xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
xC(g)?,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4?mol?/?L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为___,A的转化率为____.
(2)X=__________
(3)若继续向原平衡状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
a.向正反应方向移动 b.向逆反应方向移动 c.不移动
(4)?T?℃时,向2L密闭容器中充入4molC,反应达到平衡时,B的物质的量为______。