|
高考化学知识点总结《离子共存》考点特训(2017年冲刺版)(六)
2017-11-11 02:55:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列各组离子一定能大量共存的是
A.由水电离出的c(H+)=1×10-14mol/L的溶液中: K+、I-、Cl-、NO3-
B.在呈中性的溶液中:Al3+、Na+、CO32—、Cl—
C.在pH=12的溶液中NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1 mol·L-1的溶液中Fe3+、K+、Cl-、NO3-
|
参考答案:D
本题解析:A、由水电离出的c(H+)=1×10-14mol/L的溶液既可能呈酸性也可能呈碱性,酸性条件下,
4H++2I-+NO3- NO+I2+2H2O,不能大量共存,错误;B、在呈中性的溶液中,2Al3++3CO32—+3H2O NO+I2+2H2O,不能大量共存,错误;B、在呈中性的溶液中,2Al3++3CO32—+3H2O 2Al(OH)3+3CO2,不能大量共存,错误;C、pH=12的溶液呈碱性,碱性条件下,OH-+NH4+ 2Al(OH)3+3CO2,不能大量共存,错误;C、pH=12的溶液呈碱性,碱性条件下,OH-+NH4+ NH3·H2O,不能大量共存,错误;D、在c(H+)=0.1 mol·L-1的溶液中组内离子间不反应,能大量共存,正确。 NH3·H2O,不能大量共存,错误;D、在c(H+)=0.1 mol·L-1的溶液中组内离子间不反应,能大量共存,正确。
考点:考查离子反应、离子大量共存问题。
本题难度:一般
2、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式
| CH3COOH
| HCN
| H2CO3
| 电离平衡常数(25℃)
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7
K2=5.6×10-11
|
则下列有关说法正确的是
A.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
参考答案:D
本题解析:根据弱酸的电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO。由于酸越弱,相应的钠盐越容易水解,pH越大。A不正确,因为溶液的浓度不一定是相同的;根据溶液中电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CN-),由于所得溶液中c(Na+)>c(CN-),所以c(H+)<c(OH-),因此溶液显碱性,但当二者恰好反应时,生成的盐水解,溶液也是显碱性的,但此时a=b,所以选项B不正确;稀释是一直促进电离的,C不正确,且pH是先减小或增大;根据电荷守恒可知,选项D正确,答案选D。
点评:在比较溶液中离子浓度时,应该利用好3个守恒关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
3、选择题 常温下,在pH =1的水溶液中能大量共存的离子组是
[? ]
A. Na+? Mg2+? SO42-?Cl-
B. Al3+? NH4+?CH3COO-? ?Br-
C. K+? Fe2+? SO42-? NO3-
D. Na+? Ba2+? I-? ?ClO-
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同
B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7
C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7
D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡
参考答案:C
本题解析:
A.亚铁离子和铵根水解均显酸性,亚铁离子水解抑制铵根的水解,(NH4)2Fe(SO4)2溶液中c(NH4+)稍大。
B.如果CH3COONa固体大量过量,溶液的pH甚至可能大于7。
D.NaAlO2溶液与Na2CO3溶液混合根本就不反应。
点评:考查溶液混合酸碱性的考查。
本题难度:一般
5、选择题 下列各组离子在指定溶液中,可能大量共存的是(?)
①溶有足量氨气的无色溶液中:K+,NH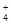 ,Na+,HSO ,Na+,HSO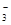 ,PO ,PO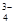 ,MnO ,MnO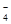
②能使pH试纸变深蓝色的溶液中:K+,Na+,AlO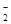 ,NO ,NO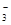 ,S ,S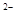 ,SO ,SO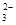
③水电离的H+浓度c(H+)=10-13mol·L-1的溶液中:Cl ,CO ,CO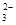 ,S2O ,S2O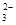 ,Fe3+,K+,Na+ ,Fe3+,K+,Na+
④加入Al能放出H2的溶液中:Na+,NH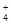 ,K+,SO ,K+,SO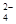 ,Cl ,Cl ,Br ,Br
⑤使石蕊变红的溶液中:Fe3+,Na+,K+,NO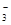 ,SO ,SO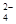 ,Cl ,Cl
⑥室温下下pH=1的溶液中:Fe2+,Al3+,K+,Na+,NO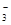 ,I ,I ,Cl ,Cl ,S ,S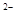
⑦含有大量Fe3+的溶液:K+,NH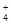 ,Na+,SCN ,Na+,SCN ,I ,I ,Br ,Br
⑧室温下,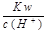 ="0.1" mol/L的溶液中:Na+,K+,SO ="0.1" mol/L的溶液中:Na+,K+,SO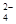 ,SiO ,SiO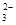 ,NO ,NO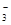
A.①③④⑥
B.①③⑥⑦
C.②④⑤⑧
D.②⑤⑦⑧
参考答案:C
本题解析:①MnO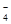 是紫色的;②能使pH试纸变深蓝色的溶液是碱性溶液,这些离子在碱性条件下可以共存;③水电离的H+浓度c(H+)=10-13mol·L-1的溶液表明水的电离受到了抑制,说明溶液可能是酸性,也可能是碱性的溶液,酸性条件下CO 是紫色的;②能使pH试纸变深蓝色的溶液是碱性溶液,这些离子在碱性条件下可以共存;③水电离的H+浓度c(H+)=10-13mol·L-1的溶液表明水的电离受到了抑制,说明溶液可能是酸性,也可能是碱性的溶液,酸性条件下CO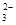 ,S2O ,S2O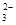 将不能共存,碱性条件下Fe3+不能共存;④加入Al能放出H2的溶液可能是酸性溶液,也可能是碱性溶液,碱性条件下NH 将不能共存,碱性条件下Fe3+不能共存;④加入Al能放出H2的溶液可能是酸性溶液,也可能是碱性溶液,碱性条件下NH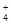 ,不能共存;⑤使石蕊变红的溶液是酸性溶液,可以共存;⑥NO ,不能共存;⑤使石蕊变红的溶液是酸性溶液,可以共存;⑥NO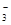 ,在酸性条件下有强的氧化性,可以氧化Fe2+,I ,在酸性条件下有强的氧化性,可以氧化Fe2+,I ,;因此不能共存;⑦含有大量Fe3+的溶液,不能与SCN ,;因此不能共存;⑦含有大量Fe3+的溶液,不能与SCN ,I ,I 共存;⑧室温下, 共存;⑧室温下, 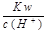 ="0.1" mol/L的溶液中,氢氧根离子的浓度为0.1 mol/L,也就是一个碱性溶液,可以共存。综上所述,选C。 ="0.1" mol/L的溶液中,氢氧根离子的浓度为0.1 mol/L,也就是一个碱性溶液,可以共存。综上所述,选C。
本题难度:一般
|