1、选择题 下列叙述正确的是?(?)
A.1molNaOH的摩尔质量为40g
B.64gSO2中含有1molO2
C.1molN2的体积约为22.4L
D.0.5molCO2约含有3.01×1023个CO2分子
参考答案:D
本题解析:摩尔质量的单位是g/mol;SO2中不含有O2分子;1molN2在标准状况下的体积约为22.4L。答案选D。
点评:气体的体积与温度压强有关,如果不强调温度和压强,则气体的体积是不确定的。
本题难度:一般
2、选择题 质量相同的下列物质中,含分子数最多的是(?)
A.O2
B.NH3
C.CO
D.CH4
参考答案:D
本题解析:假设各物质的质量为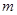 ,则
,则
A、氧气的物质的量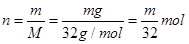 ,
,
B、氨气的物质的量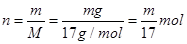 ,
,
C、一氧化碳的物质的量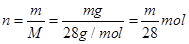 ,
,
D、甲烷的物质的量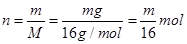 ,
,
因为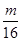 >
>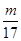 >
>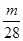 >
>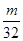 ,故含分子数最多的是D。
,故含分子数最多的是D。
点评:本题考查了物质的量的计算,熟练掌握其计算公式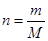 是正确解题的关键,属于基础题。
是正确解题的关键,属于基础题。
本题难度:简单
3、选择题 物质的量相等的两种气体,必然具有相同的
[? ]
A.体积
B.分子数
C.原子数
D.密度
参考答案:B
本题解析:
本题难度:简单
4、选择题 某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时mg该晶体溶于ng水中,得到vmL密度为dg·mL-1的饱和溶液,下述表达式或判断正确的是
[? ]
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A的溶解度为(100m(B-18)/nB)g
C.该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10gA投入到该饱和溶液中,析出晶体大于l0g
参考答案:AD
本题解析:
本题难度:一般
5、填空题 (1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(3)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
(4)现有m g某气体,它的摩尔质量为M g·mol-1,则
①该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
②该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______ mol·L-1。
参考答案:(1)XY3 (2)27.6% 48.3% (3)1∶1 51.5
(4)①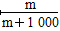 ×100% ②
×100% ②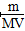
本题解析:(1)根据阿伏加德罗定律可写出化学方程式:X2+3Y2=2Z,再根据质量守恒定律,可得Z的化学式应为XY3。
(2)三种气体的平均相对分子质量为14.5×2=29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2的物质的量分数为(1-x),因此有:32x+28(1-x)=29,解得x=0.25。O2的质量分数为 ×100%=27.6%。
×100%=27.6%。
若CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则混合气体中氧的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为 ×100%=48.3%。
×100%=48.3%。
(3)设Cl2的体积为x mL,则O2的体积为(100-x)mL。
根据反应H2+Cl2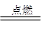 ?2HCl、2H2+O2
?2HCl、2H2+O2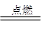 2H2O知,反应中消耗的H2为:xmL+2(100-x)mL=150 mL,解得x=50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
2H2O知,反应中消耗的H2为:xmL+2(100-x)mL=150 mL,解得x=50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
(4)①1 L水的质量是1 000 g。m g该气体溶于1 L水中,所得溶液中溶质的质量分数是:w=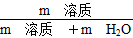 ×100%=
×100%=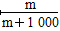 ×100%。
×100%。
②V(aq)=V L,则c=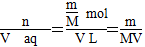 mol·L-1。
mol·L-1。
本题难度:一般