1、实验题 实验室需要480 mL 0.4 mol·L-1 的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入一定容积的容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_______________。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1 000 mL,本实验选用________。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:_________________。
(4)需要使用玻璃棒的操作有________(填序号),其作用为_________________。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1g以下用游码)________。
②某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?________。
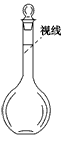
③没有进行操作步骤④________
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出__________
⑤容量瓶原来有少量水___________
参考答案:(1)①②④③⑤
(2)③
(3)天平、药匙、烧杯、胶头滴管、量筒
(4)①②③④;①:搅拌,促进溶解、②③④:引流
(5)①偏低;②偏高;③偏低;④偏低;⑤无影响
本题解析:
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.05 mol熔融的NaHSO4中含有的阳离子数为0.10NA
B.25℃,pH=12的1 L氨水中含有的OH-数为0.01NA
C.11.2 L乙烯、乙炔的混合气体中含有的碳原子数为NA
D.5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA
参考答案:B
本题解析:
正确答案:B
A.不正确,0.05 mol熔融的NaHSO4中含有的阳离子只有Na+ ,阳离子数为0.05NA
B.正确;
C.不正确,只有在标准状况下,11.2 L乙烯、乙炔的混合气体中含有的碳原子数为NA
D.不正确,5.6 g Fe和足量盐酸完全反应,只生成Fe2+ ,转移的电子数为0.2NA
本题难度:一般
3、计算题 现有H2SO4和Na2SO4混合溶液200 mL,其中硫酸的物质的量浓度为1 mol·L-1,硫酸钠的物质的量浓度为0.5 mol·L-1。若要使硫酸和硫酸钠的物质的量浓度分别为2 mol·L-1和0.2 mol·L-1,应加入质量分数为55.8%的硫酸溶液(ρ="1.35" g·mL-1)多少毫升后再加蒸馏水配制?
参考答案:应加入质量分数为55.8%的硫酸溶液(ρ="1.35" g·mL-1)58.1 mL后再加蒸馏水配制。?
本题解析:设加入V mL质量分数为55.8%的硫酸溶液,加水后溶液的体积为V (总)。
根据H2SO4的物质的量得:200 mL×10-3 L·mL-1×1 mol·L-1+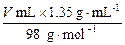 =
=
V (总)·2 mol·L-1。
根据Na2SO4的物质的量得:200 mL×10-3 L·mL-1×0.5 mol·L-1=V (总)·2 mol·L-1
计算得:V="58.1" mL,V (总)="0.5" L。
本题难度:简单
4、选择题 在标准状况下①6.72L CH4?②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
A.密度②>③>①>④
B.体积②>③>①>④
C.质量②>①>③>④
D.氢原子个数①>③>②>④
参考答案:B
本题解析:①6.72LCH4的物质的量为6.72L÷22.4L/mol=0.3mol,②3.01×1023个HCl分子的物质的量为3.01×1023÷6.02×1023/mol=0.5mol,③13.6g硫化氢的物质的量为13.6g÷34g/mol=0.4mol,④0.2mol氨气(NH3)。A、同温同压下,密度之比等于相对分子质量之比,①CH4相对分子质量为16,②HCl相对分子质量为36.5③硫化氢相对分子质量为34,④氨气相对分子质量为17,同温同压下,密度之比等于相对分子质量之比,所以密度②>③>④>①,故A不正确;B、同温同压下,体积之比等于物质的量之比,所以体积②>③>①>④,故B正确;C、①6.72LCH4的质量为0.3mol×16g/mol=4.8g②3.01×1023个HCl分子的质量为0.5mol×36.5g/mol=18.25g,③13.6g硫化氢,④0.2mol氨气(NH3)的质量为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故C不正确;D、氢原子物质的量分别为:①0.3mol×4=1.2mol,②0.5mol,③0.4mol×2=0.8mol,④0.2mol×3=0.6mol,所以氢原子数①>③>④>②,D不正确,答案选B。
本题难度:一般
5、选择题 下表是某品牌柠檬汁饮料标签的部分内容,则该饮料中维生素C(分子式为C6H8O6)的物质的量浓度为
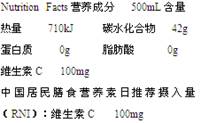
A.1.14×10—3 mol?L—1
B.0.2 mg?mL—1
C.1.42× 91eXaM.org10—3 mol?L—1
D.0.2 mol?L—1
参考答案:A
本题解析:该饮料中维生素C质量是100mg,其物质的量是0.1g÷176g/mol=0.00568mol,所以浓度是0.00568mol÷0.5L=1.14×10—3 mol?L—1,答案选A。
本题难度:简单