1ЎўСЎФсМв ПВБРУР№Ш»ҜС§УГУпөДұнҙпХэИ·өДКЗ
AЈ®јЧИ©өДөзЧУКҪЈә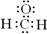
BЈ®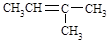 өДГыіЖЈә3ЁDјЧ»щЁD2ЁD¶ЎП©
өДГыіЖЈә3ЁDјЧ»щЁD2ЁD¶ЎП©
CЈ®ә¬78ёцЦРЧУөДөвөД·ЕЙдРФәЛЛШЈә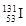
DЈ®ҙҝјоИЬТәіКјоРФөДФӯАнЈәCO32ЈӯЈ«2H2OЈҪH2CO3Ј«2OHЈӯ
2ЎўСЎФсМв ПВБР·ҙУҰЦРјУИл»№ФӯјБҝЙТФҪшРРөДКЗ
AЈ®Cl2ЎъClЈӯЎЎ
BЈ®ZnЎъ Zn2Ј«ЎЎ
CЈ®ЈИ2ЎъH2O
DЈ®CuOЎъCuCl2
3ЎўСЎФсМв ВИЛбКЗТ»ЦЦЗҝЛбЈ¬ЕЁ¶Иі¬№э40ЈҘКұ»б·ўЙъ·ЦҪвЈ¬·ҙУҰҝЙұнКҫОӘЈә
a HClO3 = bO2Ўь+ c Cl2Ўь+ d HClO4 + e H2OЎЈПВБРУР№ШЛө·ЁІ»ХэИ·өДКЗ
AЈ®УЙ·ҙУҰҝЙИ·¶ЁЈәСх»ҜРФHClO3ЈҫO2
BЈ®ИфВИЛб·ЦҪвЛщөГ»мәПЖшМеЈ¬lmol»мәПЖшМеЦКБҝОӘ45gЈ¬Фт·ҙУҰ·ҪіМКҪҝЙұнКҫОӘЈә3HClO3 = 2O2Ўь+ C12Ўь+ HClO4 + H2O
CЈ®УЙ·ЗҪрКфРФClЈҫSЈ¬ҝЙНЖЦӘЛбРФHClO3ЈҫH2SO4
DЈ®Иф»ҜС§јЖБҝКэa=8Ј¬b=3Ј¬ФтёГ·ҙУҰЧӘТЖөзЧУКэОӘ20eЈӯ