1、选择题 (15分) 现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族, E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。
请回答下列问题:
(1)元素C在周期表中的位置是_______________
元素E的原子结构示意图为
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为 , 该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示) 。
参考答案:(15分)
(1)第二周期VA; 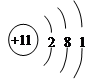 (4分)
(4分)
(2)NH3.H2O+H+=NH4++H2O (3分)
(3)H2+2OH--2e-=2H2O ( 3分) 减小 (2分)
(4)N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1 (3分)
本题解析:B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具,则B为C元素;A与D形成的化合物常温下为液态,则A为H元素、D为O元素;根据原子序数依次增大,C为N元素;已知A与E、D与F分别同主族,这七种元素都位于短周期,A分别与F、G形成的气体分子电子总数相等,所以E为Na元素、F为S元素、G为Cl元素。
(1)C为N元素,在周期表中的位置是:第二周期VA族; Na原子根据示意图: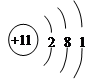
(2)C的气态氢化物的水化物为NH3?H2O,最高价氧化物的水化物为HNO3,发生酸碱中和反应,离子方程式为:NH3.H2O+H+=NH4++H2O
(3)A、D的单质分别为H2、O2,A、D、E形成的离子化合物为NaOH,形成燃料电池,负极发生H2失去电子的反应,电极方程式为:H2+2OH--2e-=2H2O;电池反应为2H2+O2=2H2O,生成了H2O,使NaOH溶液的浓度减小,所以电解质溶液的pH将减小。
(4)化合物C2A4为N2H4,完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,则生成物是N2和H2O,0.25 mol N2H4完全燃烧放出热量为133.5 kJ,则1mol N2H4完全燃烧放出热量为534 kJ,所以热化学方程式为:N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1
考点:本题考查元素的推断、原子结构示意图、物质的性质、原电池原理、热化学方程式的书写。
本题难度:一般
2、填空题 (14分)燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
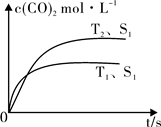
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量
c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=-746.5kJ·mol-1;(2)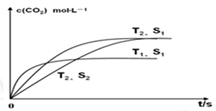
(3)①40% , 0.027;②c d;③向左,0.14 ;(4)H2O2+2e-+2H+=2H2O。
本题解析:(1)NO和CO转化成无污染的气体N2和CO2,②×2-①得出:2CO(g)+2CO(g)=N2(G)+2CO2(g) △H=-283×2-180.5kJ·mol-1=-746.5kJ·mol-1;(2)根据题意增大固体表面积可提高化学反应速率,S1>S2,在温度相同的情况下S1反应速率快达到平衡所用的时间短,图像:
 ;
;
(3)①消耗的n(CO)=(1.2-0.8)×2mol=0.4mol,根据反应方程式消耗的n(CO)和消耗的n(NO)是相等的,即消耗n(NO)=0.8mol,NO的转化0.8/2×100%=40%,0~15minNO的反应速率:v(NO)=0.8/(2×15)mol/(L·min)=0.027)mol/(L·min);②a、减小容器的体积,虽然平衡右移,但各组分的的浓度是增加的,错误;b、增加CO的量,CO的浓度增大,错误;c、此反应是放热反应,降低温度,平衡右移,CO的浓度减少,正确;d、增大容器的体积,虽然平衡左移,但各组分的浓度减小,正确,选项cd正确;③15min的平衡常数K=[c(N2)×c2(CO2)]/[c2(NO)×c2(CO)]=(0.2×0.42)/(0.82×0.62]=0.14,温度不变平衡常数不变,20min后再次达到化学平衡的平衡常数仍为0.14,K=[c(N2)×c2(CO2)]/[c2(NO)×c2(CO)]=(0.4×0.42)/(0.82×0.82]=0.16>0.14,化学平衡向左移动;(4)根据原电池的工作原理,正极上发生还原反应化合价降低,SO2具有还原性,H2O2具有氧化性,因此过氧化氢在正极上得电子,H2O2中的O是-1价变成0价,得到2mole-,根据反应前后所带电荷数相等,推出有H+参加反应,即H2O2+2H++2e-=2H2O。
考点:考查反应热的计算、化学平衡及化学平衡常数的计算、电极反应式的书写等知识。
本题难度:困难
3、填空题 甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l) ΔH2
CH3OH(g) + H2O(l) ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g) ΔH3=-41.1 KJ/mol ③
H2O (l) =H2O (g) ΔH4=+44.0KJ/mol ④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol?L-1)变化如下表所示:(前6min没有改变条件)
| 2min
| 4min
| 6min
| 8min
| …
|
CO
| 0.07
| 0.06
| 0.06
| 0.05
| …
|
H2
| x
| 0.12
| 0.12
| 0.2
| …
|
CH3OH
| 0.03
| 0.04
| 0.04
| 0.05
| …
|
①x= 。
②250℃时该反应的平衡常数K值为: (不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是 。
④第8min时,该反应是不是达到平衡状态 。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ. 。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极: 。
参考答案:(1)-93.0 KJ/mol (3分)
(2)①x=0.14 (2分)
② (2分)
(2分)
③增加了1 mol氢气;(2分)
④ 不是(2分)
⑤温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低。(2分)
(3)阳极:CH3OH+H2O=6H++CO2↑+6e-或CH3OH+H2O-6e-=6H++CO2↑;(3分)
本题解析:(1)根据盖斯定律,②=①-(③+④),所以ΔH2=ΔH1-(ΔH3+ΔH4)=-93.0 KJ/mol;
(2)①CO在2~4min浓度减少0.01mol/L,则H2的浓度减少0.02mol/L,4min时氢气的浓度是0.12mol/L,所以x=0.02mol/L+0.12mol/L=0.14 mol/L;
②250℃时在6min时达平衡,根据平衡常数的计算式得K=
③8min时CO的浓度减小,氢气的浓度增大,甲醇的浓度增大,说明改变条件平衡正向移动,CO浓度减少0.01mol/L,则氢气的浓度减少0.02mol/L,所以改变条件时氢气的浓度是0.22mol/L,与6min时相比氢气的浓度增加0.1mol/L,物质的量增加1mol,所以改变的条件是氢气增加1mol;
④用8min时生成物的浓度幂除以反应物的浓度幂之积,与 相比,若相等则是平衡状态,若不等则不是平衡状态;
相比,若相等则是平衡状态,若不等则不是平衡状态;
⑤温度太低,反应速率小,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低,所以温度以催化剂的活性为主进行选择;
(3)电解甲醇水溶液比电解相同物质的量的水多,电解1molH2O得1mol氢气,则电解1mol甲醇水溶液产生的氢气将大于1mol,所以电解1mol甲醇水溶液产生的H+将大于2mol,说明甲醇分子中的氢原子通过电解液成为H+,故电解甲醇水溶液的阳极反应式为CH3OH+H2O-6e-=6H++CO2↑。
考点:考查盖斯定律的应用,化学平衡的有关计算,对反应条件的分析,用平衡常数判断平衡状态,电解原理的应用
本题难度:困难
4、填空题 Ⅰ(8分)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填
“高”或“低”)。
(3)物质中的化学能通过化学反应转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________
Ⅱ.同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g) ====P4O10(s) ΔH=-2 983.2 kJ·mol-1 ①
P(红磷,s)+  O2(g)="==="
O2(g)="==="  P4O10(s) ΔH=-738.5 kJ·mol-1 ②
P4O10(s) ΔH=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为____________。相同状况下,能量状态较低的是____________;白磷的稳定性比红磷____________(填“高”或“低”)。
参考答案:Ⅰ (1)放热 (2)高 (3) 热能 (4)低 (5)2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或NaOH+HCl===NaCl+H2O等合理答案均可)
ⅡP4(白磷,s)====4P(红磷,s);ΔH=-29.2 kJ· mol-1 红磷 低
本题解析:I(1)U形管中甲处液面下降乙处液面上升,说明该反应放热,温度升高,瓶内的压强增大;
(2)根据化学反应与能量的关系判断放热反应是反应物的总能量高于生成物的总能量,所以A和B的总能量比C和D的总能量高;
(3)温度升高,说明物质中的化学能通过化学反应转化成热能释放出来;
(4)反应热=反应物的总键能-生成物的总键能,该反应放热,说明反应物的总键能低于生成物的总键能;
(5)放热反应的例子有燃烧反应、活泼金属与酸的反应、中和反应等,举一例即可;
II根据盖斯定律可知,白磷转化为红磷的热化学方程式=①-4②,即P4(白磷,s)====4P(红磷,s);ΔH=(-2 983.2 kJ·mol-1)-4×(-738.5 kJ·mol-1)=-29.2 kJ· mol-1;该反应是放热反应,说明红磷的能量低于白磷,所以白磷的稳定性比红磷低。
考点:考查化学反应与能量的关系,反应热与键能的关系,物质稳定性的判断
本题难度:一般
5、简答题 (6分)(1)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,
肼—空气燃料电池放电时:负极的电极反应式是:
(3)下图是一个电化学过程示意图。假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)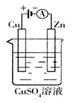
参考答案:(6分)(1)N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-624kJ/mol
(2)N2H4+4OH--4e-=4H2O+N2↑ (3)112
本题解析:(1)32g肼恰好是1mol,所以热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-624kJ/mol。
(2)原电池中负极是失去电子的,肼在负极通入。又因为电解质是氢氧化钾,所以负极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)根据装置可知,铜和电源的正极相连,作阳极。因此反应中转移电子是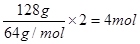 所以根据电子得失守恒可知,消耗氧气是1mol,则空气是5mol,标准状况下的体积是5mol×22.4L/mol=112L。
所以根据电子得失守恒可知,消耗氧气是1mol,则空气是5mol,标准状况下的体积是5mol×22.4L/mol=112L。
本题难度:一般