1、填空题 (8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
参考答案:(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+
(4)中 mol·L-1
本题解析:本题考查化学平衡的移动、热化学方程式、溶解平衡、溶液中离子浓度大小比较等知识,意在考查考生运用化学基本理论知识的能力。(1)在恒温、恒压条件下向平衡体系中通入氩气,容器体积增大,反应气体的浓度减小,平衡将向气体物质的量增大的方向移动,即向左移动。
(2)根据盖斯定律,ΔH=ΔH1+ΔH2-ΔH3=-77.6 kJ·mol-1。
(3)Ksp[Mg(OH)2]>Ksp[Cu(OH)2],MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀。
(4)因为氨水与盐酸反应后,生成氯化铵溶液,依据电荷守恒得c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),所以溶液呈中性;NH3·H2O的电离常数Kb== mol/L。
本题难度:一般
2、选择题 在5 mL 0.1 mol·L-1 KI溶液中滴加0.1 mol·L-1 FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3与KI的反应是可逆反应的实验(含现象)是( )
A.滴加AgNO3溶液,有黄色沉淀产生
B.加入CCl4振荡,下层液体为浅紫色
C.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加AgNO3溶液,有白色沉淀产生
D.加入CCl4振荡,下层液体为浅紫色;取上层清液,滴加KSCN溶液,溶液显红色
参考答案:D
本题解析:依据方程式2I-+2Fe3+ I2+2Fe2+可知I-过量,只要证明溶液中含有Fe3+即可证明该反应为可逆反应
I2+2Fe2+可知I-过量,只要证明溶液中含有Fe3+即可证明该反应为可逆反应
本题难度:一般
3、填空题 合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。?可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
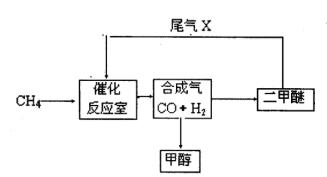
(1)写出用合成气生产二甲醚的化学方程式?。
 ?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
(3)工业上一般采用下列两种反应合成甲醇:
 反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?
反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?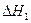
 反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)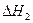
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
由表中数据判断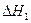 ?0(填“>”、“=”、“<”)。
?0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+ O2(g)
O2(g)?CO2(g)+2H2(g)?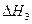 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+ O2(g)
O2(g)?H2O(g)?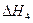 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则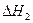 =?。
=?。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式?。
参考答案:(1)①2CO+4H2?CH3OCH3+H2O?3分
(2)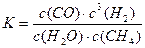 (其它合理表达 www.91eXam.org也给分)? 2分
(其它合理表达 www.91eXam.org也给分)? 2分
(3)① <? 2分?②-48.9kJ·mol-1?3分
(4)CH3OCH3+160H一一12e一?2CO23一+11H2O? 3分
本题解析:略
本题难度:一般
4、选择题 在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)  3C(g)+D(g),达到平衡状态的是(?)
3C(g)+D(g),达到平衡状态的是(?)
A、反应器内压强不随时间变化而变化?
B、反应器内A、B、C、D物质的量比为1:3:3:1
C、生成A的速率和生成的D的速率相等
D、生成 1mol A同时有3 mol C被消耗
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,B不正确。由于反应前后条件是不变的,所以压强始终是不变的,A不正确。C中反应速率的方向是相反的,且满足速率之比是相应的化学计量数之比,所以C是正确的。D中反应速率的方向是相同的,因此不正确。答案选C。
本题难度:一般
5、选择题 已知:①CO(g)+H2O(g) CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g)?ΔH3
CO(g)+3H2(g)?ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
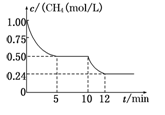
A.ΔH3=+206.1 kJ/mol
B.反应③进行到10 min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
参考答案:D
本题解析:A、正确,①+②得△H3=-41.2 kJ/mol+247.3 kJ/mol=+206.1 kJ/mol
B、正确,升高温度,平衡正向移动;C、正确,206.1 kJ/mol×0.5mol="103.05" kJ;D、不正确,CH4的转化率将减小。选D。
本题难度:一般