|
高考化学知识点总结《物质的量》高频考点强化练习(2017年最新版)(八)
2017-11-11 03:16:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 若NA表示阿伏加德罗常数的值,下列说法正确的是
A.2 .24 L NH3溶干1 L水中得到OH-数约为0.1NA
B.l 4 g N2与CO的混合气体含有的原于数目为NA
C.25℃时pH=13的NaOH溶液中含有OH-的数目为0 .l NA
D.含l mol H2 SO4的浓硫酸与足量铜反应转移的电子为NA
|
参考答案:B
本题解析:A、未指明标准状况,所以2.24L的氨气的物质的量不是0.1mol,且氨气溶于水生成一水合氨是弱碱,不完全电离,无法判断OH-数,错误;B、氮气和CO的相对分子质量相同,所以14g的混合气体的物质的量是0.5mol,且二者都是双原子分子,所以混合气体中的原子数目是NA,正确;C、25℃时pH=13的NaOH溶液中含有OH-的浓度是0.1mol/L,但离子数目因未知溶液体积而无法确定,错误;D、浓硫酸与铜的反应中,随反应的进行,硫酸逐渐变稀,而稀硫酸与铜部分应,所以转移电子的数目小于NA,错误,答案选B。
考点:考查阿伏伽德罗常数的理解应用
本题难度:一般
2、选择题 已知标准状况下:①6.72LCH4②3.01×1023HCl③23.1gCCl4④2.3gNa,下列对四种物质的关系由小到大表示正确的是( )
A.体积④<①<②<③
B.密度①<④<③<②
C.原子数④<③<②<①
D.质量④<①<③<②
参考答案:①6.72LCH4,n(CH4)=6.72L22.4L/mol=0.3mol;②3.01×1023HCl,n(HCl)=3.01×10236.02×1023=0.5;③n(CCl4)=23.1g154g/mol=0.15mol;④2.3gNa,n(Na)=2.3g23g/mol=0.1mol,
A.物质的量越大,其体积越大,则体积为④<③<①<②,故A错误;
B.摩尔质量越大,其密度越大,则密度为①<②<③,Na为固体,其密度最大,故B错误;
C.①②③④中原子的物质的量分别为1.2mol、1mol、0.75mol、0.1mol,则原子数④<③<②<①,故C正确;
D.①②③④的质量分别为4.8g、18.25g、23.1g、2.3g,则质量为④<①<②<③,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 (每空1分,共4分)已知在标况下的四种气体①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3
用相应的序号填写下列空白:
(1)体积最大的是 ;(2)密度最大的是 ;
(3)质量最小的是 ;(4)含氢原子数最少的是 。
参考答案: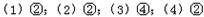
本题解析:略
本题难度:一般
4、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
A.2.3g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6L甲醛所含的电子数为4×6.02×1023
D.100mL 1mol·L-1醋酸溶液中,H+的个数为0.1×6.02×1023
参考答案:C
本题解析:钠在反应中只能失去1个电子,则2.3g钠只能失去0.1mol电子,A不正确;标准状况下,乙醇不是气体,不能适用于气体摩尔体积,B不正确;标准状况下,5.6L甲醛的物质的量是0.25mol,甲醛含有1×2+6+8=16个电子,所以0.25mol甲醛含有的电子的物质的量是4mol,C正确;D中醋酸是弱酸,存在电离平衡,溶液中氢离子的物质的量小于0.1mol,D错误,答案选C。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
5、填空题 绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围 ;
②若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
参考答案:(1)7.14 mol·L-1 ; >(各2分) (2)0.77(2分)
(3)FeSO4·Fe2(SO4)3·10H2O (3分) (4)①42~60mL(3分);②0.33或1/3(3分)
本题解析:试题分析:(1)密度为1.4g/cm3,50%的硫酸物质的量浓度为:
c= ="7.14" mol·L-1, ="7.14" mol·L-1,
50%的硫酸与30%的硫酸等体积(假设羰基为1,密度分别是ρ1和ρ2)混合,混合酸的浓度为
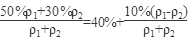 >40%。 >40%。
(2)因为20%发烟硫酸为80克H2SO4含SO3 20克,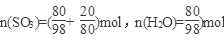 , ,
若用SO3·nH2O表示20%的发烟硫酸,则n=0.77。
(3)配制溶液加入足量的BaCl2溶液,过滤得沉淀9.32克,n(SO42-)=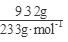 =0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2× =0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2×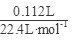 =0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。 =0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
(4)假设固体混合物全部为CuS,则n(CuS)=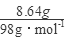 =0.09mol,需要硝酸的物质的量为y, =0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS + 8H+==3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol。
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应。
NO3-+3Fe2++4H+==NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol,解得V=60,
所以V值范围为:42<V<60,
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2+ + 4H+→NO↑+3Fe3++2H2O
3mol 4
0.048L×2mol/L n
解得:n=0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
x 16x/3
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
y 8y/3
16x/3+8y/3=0.272②
由①②解得:x=0.036; y=0.03
混合物中CuS的质量分数为: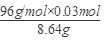 ×100%≈33.33%。 ×100%≈33.33%。
本题难度:困难
|