1、选择题 钢铁在潮湿的空气中会发生吸氧腐蚀,下列判断正确的是( )
A.负极反应为:Fe=Fe2++2e-
B.正极反应为:O2+4e-+4H+=2H2O
C.腐蚀过程中,电子从负极流向正极
D.钢柱在水下的部分比在空气与水交界处更容易发生吸氧腐蚀
参考答案:A.负极上铁失电子发生氧化反应,电极反应式为Fe=Fe2++2e-,故A正确;
B.正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,故B错误;
C.腐蚀过程中,构成原电池,电子从负极铁流向正极碳,故C正确;
D.水中氧气的溶解度较小,所以钢柱在水下的部分比在空气与水交界处更难发生吸氧腐蚀,故D错误;
故选AC.
本题解析:
本题难度:一般
2、选择题 钢铁腐蚀发生得最普遍的是
[? ]
A.化学腐蚀
B.析氢腐蚀
C.吸氧腐蚀
D.摩擦损耗
参考答案:C
本题解析:
本题难度:简单
3、填空题 (11分)按下图装置进行实验,并回答下列问题
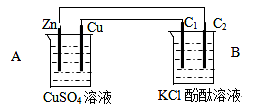
⑴判断装置的名称:A池为__________池,B池为___________池。
⑵铜极为__________极,电极反应式为??,
石墨棒C1为______极,电极反应式为________________________?,
石墨棒C2附近发生的实验现象为______________________________?。
⑶当C2极析出224mL气体(标准状态)时,左侧烧杯中溶液的质量_________(增加、不变或减少)_________g。
参考答案:(11分)(电极反应每个2分,其余每空1分)
⑴原电,?电解。
⑵正,Cu2+ + 2e—=Cu;?阳,2Cl—+2e—= Cl2↑;?溶液变红色。
⑶增加? 0.01
本题解析:(1)由图示可知A池是锌铜原电池,做为电源电解B池,连接Zn负极的C2电极为阴极,连接Cu正极的C1电极为阳极。
(2)
A池为原电池:Zn + Cu2+==Zn2+ + Cu
负极:Zn-2e-=Zn2+?正极:Cu2++2e-=Cu
B池为原电池:2KCl+2H2O =2KOH+H2↑+Cl2↑
阴极:2H++2e-=H2↑?阳极:2Cl—+2e—= Cl2↑
在阴极由于氢离子的放电,导致溶液呈碱性,酚酞呈红色。
(3)原电池中每进入1 molZn而析出1 molCu,故溶液的质量增加65-64 =" 1" g
H2? ~? 2e-? ~?△m
1mol? 1 g
0.01mol? 0.01g
本题难度:一般
4、选择题 全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M一ne一——Mn+
D.这种方法称为牺牲阳极的阴极保护法
参考答案:B
本题解析:由题意知,加入金属棒X后形成原电池,并使其作为阳极铁作阴极发生反应,避免铁失去电子被腐蚀,A、潮湿的土壤中有水和氧气,形成原电池环境,易被腐蚀,故A正确;B、金属棒X的材料比铁活泼,替代钢铁进行反应,但无法判断是否比镁活泼,故B错误;C、金属棒X作为负极发生反应失去电子,M一ne一——Mn+,故C正确;D、将还原性较强的金属X作为保护极,与被保护金属铁相连构成原电池,还原性较强的金属X作为负极发生氧化反应而消耗,被保护的金属铁作为正极就可以避免腐蚀,这种方法牺牲了阳极(原电池的负极)保护了阴极(原电池的正极),是牺牲阳极的阴极保护法,故D正确。
本题难度:一般
5、选择题 某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a 和 b 不连接时,铁片上会有金属铜析出
B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变
成浅绿色
D.a 和 b 分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
参考答案:D
本题解析:A.金属性:Fe>Cu,所以发生:Fe+Cu2+= Fe2++Cu。正确。B.该装置为原电池,铁作负极,铜作正极,电子由铁经导线流向Cu电极,在Cu电极上发生反应:Cu2++2e-=Cu。正确。C.通过A、B的分析发现:无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色。正确。D.a 和 b 分别连接直流电源正、负极,该装置为电解池,a 是阳极, b是阴极。Cu2+向负电荷多的铁电极方向移动。错误。
本题难度:一般