1、选择题 下列物质的主要成分不是SiO2的是
A.石英
B.水晶
C.金刚砂
D.玛瑙
参考答案:C
本题解析:金刚砂的主要成分是碳化硅,其他三项的主要成分都是二氧化硅.
本题难度:困难
2、选择题 从经济效益和环保考虑,大量制取硝酸铜最宜采用的方法是
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu→CuO→Cu(NO3)2
D.Cu+AgNO3→Cu(NO3)2
参考答案:C
本题解析:分析:从经济角度出发,那么也就是说在制取等量的硝酸铜时,所用的原料是最少的最便宜的成本最低;从环境保护的角度出发,在制取硝酸铜是最好不要对环境造成污染.结合这两个原因可以对选项一一排除.
解答:A、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,HNO3利用率不高,NO2是有毒气体,污染环境,故A错误.
B、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,HNO3利用率不高,NO是有毒气体,污染环境,故B错误.
C、2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O,该反应过程原料的利用率高,没有有毒气体生成,不污染环境,故C正确;
D、Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3成本较高,同时AgNO3会对环境造成一定的污染,主要是重金属污染,故D错误;
故选:C;
点评:本题考查了学生根据所学的知识来判断如何从环保和经济的角度制取硝酸铜,培养了大家的环保概念和保护和合理使用金属资源的意思.
本题难度:困难
3、选择题 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是
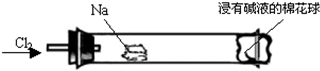
A.反应生成的大量白烟是氯化钠晶体
B.钠着火燃烧产生苍白色火焰
C.浸有NaOH溶液的棉球用于吸收未反应的氯气,以免污染空气
D.用干燥的淀粉碘化钾试纸可以检验氯气是否被完全吸收
参考答案:B
本题解析:分析:氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,火焰呈黄色,氯气易与NaOH溶液反应而被吸收,氯气具有强氧化性,与碘化钾发生置换反应.
解答:A.氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量白烟,故A正确;
B.钠着火燃烧产生黄色火焰,故B错误;
C.氯气有毒,不能排放到空气中,氯气易与NaOH溶液反应而被吸收,故C正确;
D.氯气具有强氧化性,与碘化钾发生置换反应,可根据其颜色变化判断氯气是否被碱液完全吸收,故D正确.
故选B.
点评:本题考查氯气的性质,题目难度不大,注意相关基础知识的积累.
本题难度:简单
4、选择题 德国人弗里茨 ·哈伯(Fritz Haber)因发明合成氨的方法获得1918年诺贝尔化学奖,他的发明不仅大大提高了农作物的产量,同时也提高了硝酸、炸药的产量.下列说法中正确的是
A.N2和H2在点燃或光照的条件下可以合成氨
B.氨和硝酸都是电解质
C.氨遇到湿润的红色石蕊试纸会变蓝
D.由氨制取硝酸的过程中,氮元素被还原
参考答案:C
本题解析:N2和H2要在催化剂、加热、加压的条件下才能生成氨.氨是非电解质.由氨制取硝酸的过程中,氮元素的化合价升高,被氧化.
本题难度:困难
5、选择题 设NA为阿伏加德罗常数,下列说法正确的是
A.常温常压下,46?g的NO2和N2O4混合气体含有的原子数为3NA
B.200mL?1mol/L?Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA
C.9gD2O中含有的电子数为5NA
D.Na2O2与H2O反应生成1.12L?O2(标准状况),反应中转移的电子数为0.2NA
参考答案:A
本题解析:分析:A、NO2和N2O4最简式相同,只需要计算46gNO2中所含原子数;
B、铝离子水解;铝离子数减少;
C、质量换算物质的量结合分子式计算电子数;
D、Na2O2与H2O反应,过氧化钠自身氧化还原反应,氧元素化合价从-1价变化为-2价和0价;生成1molO2,转移电子为2mol;
解答:A、NO2和N2O4最简式相同,只需要计算46gNO2中所含原子数;46gNO2物质的量为1mol,含原子数3NA,故A正确;
B、铝离子水解;铝离子数减少;200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数小于NA,故B错误;
C、质量换算物质的量结合分子式计算电子数;9gD2O物质的量=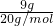 =
= mol,含有的电子数=
mol,含有的电子数= ×(1×2+8)×NA=4.5NA,故C错误;
×(1×2+8)×NA=4.5NA,故C错误;
D、Na2O2与H2O反应,过氧化钠自身氧化还原反应,氧元素化合价从-1价变化为-2价和0价;生成1molO2,转移电子为2mol,生成1.12L O2(标准状况)物质的量为0.5mol,反应中转移的电子数为NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,盐类水解的应用,氧化还原反应的电子转移数的计算方法.
本题难度:一般