1、选择题 如图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是
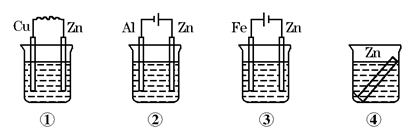
A.③①④②
B.①②④③
C.①②③④
D.②①④③
参考答案:D
本题解析:腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀;装置①中锌作负极,发生电化学腐蚀,加快锌的腐蚀,装置②中锌作电解池阳极,在外加电源的作用下,锌的腐蚀速率更快,装置③中锌作电解池阴极,为阴极电保护法,不易被腐蚀,装置④中发生化学腐蚀,所以腐蚀速率由快到慢的顺序为②①④③,选D。
本题难度:一般
2、填空题 有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
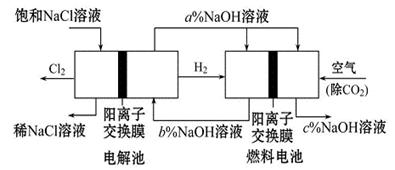
回答下列有关问题:
(1)通入空气的电极为 ?(写电极名称)。燃料电池中阳离子的移动方向?(“从左向右”或“从右向左”)。
(2)电解池中产生20 mol Cl2,理论上燃料电池中消耗?mol O2。
(3)a、b、c的大小关系为:?。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池放电时正极反应式是?。
参考答案:(1)正极?从左向右?(2)10?(3)c>a>b?
(4) NiO(OH)+H2O+ e-= Ni(OH)2+ OH-
本题解析:分析题给装置图知,该装置是以碱性氢氧燃料电池电解饱和食盐水的装置;(1)根据燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,正极是氧气发生得电子得还原反应,则通空气的电极为正极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极,从左向右;(2)电解池中产生20mol Cl2,依据电子守恒,结合电极反应式O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,计算得到生成氧气10mol;(3)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,即c>a>b;(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,镍元素的化合价由+3价降为+2价,发生还原反应,作正极,电极反应式为NiO(OH)+H2O+ e-= Ni(OH)2+ OH-。
本题难度:一般
3、选择题 下列说法不正确的是?
[? ]
A、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗
B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜
C、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净
D、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品
参考答案:A
本题解析:
本题难度:一般
4、选择题 铁在下列四种情况中腐蚀速率判断正确的是

A.a>b>c>d
B.b>a>d>c
C.d>c>b>a
D.b>d>a>c
参考答案:B
本题解析:试题分析:a、铁的吸氧腐蚀,原电池中铁为负极,加速其腐蚀;b、原电池中铁做负极,铁与硫酸反应,腐蚀速率大于a;c、铁做阴极,外加电源的阴极保护法,不会腐蚀;d、牺牲阳极的阴极保护法,铁被保护,但效果没有c好。所以腐蚀速率判断为b>a>d>c,B正确。
考点:考查电化学知识。
本题难度:困难
5、选择题 下列叙述的方法不正确的是
[? ]
A.金属的电化学腐蚀比化学腐蚀更普遍?
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀?
D.用牺牲锌块的方法来保护船身
参考答案:B
本题解析:
本题难度:简单