1、选择题 某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,该氮的氧化物是?
A.N2O
B.NO
C.NO2
D.N2O5
参考答案:B
本题解析:从反应产物N2和CO2的系数之比为1∶2得出参加反应的氮的氧化物NOx和CO的系数之比为2∶2,即:2NOx+2CO→N2+2CO2,由氧原子守恒可知x=1,即NO。
本题难度:一般
2、计算题 (9分) 在500mL? 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液?多少毫升?
参考答案:(1)设生成的气体是X(标准状况),则
3Cu?+? 8HNO3=3Cu(NO3)2+4H2O+2NO↑
3×64g? 8mol? 2×22.4L
1.92g? n(HNO3)? X
所以有x=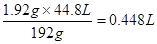
消耗硝酸n(HNO3)=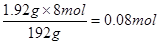
(2)原硝酸的物质的量是0.5L×0.2mol/L=0.1mol
所以剩余硝酸是0.1mol-0.08mol=0.02mol
则氢离子的浓度是0.02mol÷0.5L=0.04mol/L
(3)根据铜原子守恒可知,生成硝酸铜是1.92g÷64g/mol=0.03mol
因此反应后的溶液中含有0.02mol硝酸和0.03mol硝酸铜
所以要使溶液中的Cu2+全部转化为Cu(OH)2沉淀
需要氢氧化钠的物质的量是0.02mol+0.03mol×2=0.08mol
体积是0.08mol÷0.2mol/L=0.4L=400ml
本题解析:考查根据方程式进行的有关计算。
本题难度:一般
3、选择题 室温时,容量为18 mL的试管里充满NO2气体,然后将它倒置于水中,直到管内水面不再上升为止,再通入6 mL O2,最后试管内还有( )?
A.3 mL O2
B.1.5 mL O2?
C.3 mL NO
D.1.5 mL NO?
参考答案:B?
本题解析:18 mL NO2溶于水3NO2~NO,可产生NO为6 mL,再通入6 mL? O2,发生4NO+3O2+2H2O4HNO3,43="6" mLn(O2),n(O2)="4.5" mL,所以余n(O2)="6" mL-4.5 mL="1.5" mL,答案?为B。
本题难度:简单
4、实验题 (14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 混合不振荡
| 剧烈反应,使木条复燃
| 3.5分钟
|
块状
| ?
| 反应较慢,火星红亮但木条未复燃
| 30分钟
|
①写出H2O2反应的化学方程式?。
②实验结果说明催化剂作用的大小与?有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
| 操作情况
| 反应完成所需的时间
| 收集到气体体积
| 反应后液体温度
|
a1%的150mL
| ?
| 11分钟
| 539mL
| 24℃
|
a2%的15mL
| 混合不振荡
| 1分20秒
| 553mL
| 56℃
|
a3%的7.5mL
| ?
| 9秒
| 562mL
| 67℃
|
请简要说明:
①反应完成所需的时间不同的原因?。
②反应后液体温度不同的原因?。
③收集到气体体积不同的原因?。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式:?。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
参考答案:(每空2分,共14分)
(1)①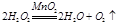
②催化剂的表面积(聚集状态)
(2)①溶液质量分数不同,液体温度不同
②反应放热相同,但液体的量不同
③液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
(3)①H2O2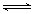 HO2-+H+(H2O2
HO2-+H+(H2O2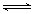 HOO-+H+)
HOO-+H+)
②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
本题解析:(1)①双氧水在催化剂的作用下,分解生成氧气,反应的方程式是2H2O2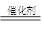 2H2O+O2↑。
2H2O+O2↑。
②根据反应完成所需的时间课判断,催化剂作用的大小与催化剂的表面积(聚集状态)有关系。
(2)①由于溶液的质量分数不同,同时溶液的温度不同,从而导致反应速率不同,所以反应完成所需的时间不同。
②由于双氧水的质量相同,所以反应放出热量相同,但液体的量不同,所以溶液的温度是不同的。
③由于液体的量不同,且液体温度不同,从而影响气体在溶液中的溶解量,所以收集到的氧气是不同的。
(3)①双氧水可以看作是二元弱酸,电离是分步的,即H2O2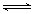 HO2-+H+(H2O2
HO2-+H+(H2O2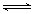 HOO-+H+)。
HOO-+H+)。
②如果是双氧水有较强氧化性所致,则再加入氢氧化钠溶液,是不能显红色的,加粗可以鉴别,即在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对。
本题难度:一般
5、填空题 (12分)羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+?+?
②5Ca(OH)2+3H3PO4=?
(2)与方法A相比,方法B的优点是?。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
?。
(4)图中所示3种钙盐在人体中最稳定的存在形式是?(填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因?。
参考答案:(1)①10NH4NO3? 3H2O?②Ca5(PO4)3OH↓+9H2O
(2)唯一副产物为水,工艺简单
(3)反应液局部酸性过大,会有CaHPO4产生
(4)Ca5(PO4)3OH
(5)酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)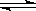 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
本题解析:樊守青
本题难度:一般