1、选择题 将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.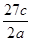
B.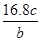
C.
D.
参考答案:C
本题解析:氢气的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为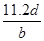 ;铝的物质的量是
;铝的物质的量是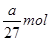 ,转移电子的物质的量是
,转移电子的物质的量是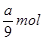 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为 ,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
点评:该题的关键是明确反应的原理,以及微粒个数与阿伏加德罗常数的关系,如何结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力。
本题难度:一般
2、选择题 以下物质间的每步转化通过一步反应都能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.S→SO3→H2SO4→MgSO4
D.Si→SiO2→H2SiO3
参考答案:A.Al2O3可以先与酸反应生成Al3+,然后与碱反应生成Al(OH)3,不能一步实现,故A错误;
B.铁与盐酸反应生成氯化亚铁,氯化亚铁与碱反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,每步转化都能一步反应实现,故B正确;
C.S→SO3的转化,应硫先与氧气反应生成二氧化硫,二氧化硫再与氧气反应生成三氧化硫,硫不能直接反应生成三氧化硫,故C错误;
D.二氧化硅不能与水反应生成硅酸,二氧化硅与先氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,故D错误;
故选B.
本题解析:
本题难度:一般
3、简答题 将15.6gNa2O2与2.7gA1粉混合后,投入足量的水中,充分反应(没能产生的气体全部放出).
(1)Na2O2与水反应的离子方程式为______;
15.6gNa2O2在该反应中转移电子的物质的量为______;
(2)反应结束时生成气体的体积在标准状况下为______;
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是______(用含a的代数式表示,结果可不化简).
参考答案:(1)过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为2Na2O2+2H2O=4N+a+4OH-+O2↑,
15.6gNa2O2的物质的量为15.6g78g/mol=0.2mol,过氧化钠完全反应,反应中过氧化钠起氧化剂、还原剂作用,各占12,
转移电子数为0.2mol×12×2=0.2mol,
故答案为:2Na2O2+2H2O=4N+a+4OH-+O2↑;0.2mol;
(2)15.6gNa2O2的物质的量为15.6g78g/mol=0.2mol,令生成的氢氧化钠的物质的量为xmol,氧气为ymol,则:
? 2Na2O2+2H2O═4NaOH+O2↑、
? 2? 4? 1
? 0.2mol?xmol? ymol
所以x=0.4,y=0.1.
2.7gA1粉的物质的量为0.1mol,由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,0.1mol铝完全反应需要氢氧化钠0.1mol,铝完全反应,令铝反应生成氢气zmol,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2? 3
0.1mol? zmol
所以z=0.15,
所以在标准状况下反应结束时生成气体的体积为(0.1mol+0.15mol)×22.4L/mol=5.6L.
故答案为:5.6L;
(3)若Al和Na2O2与水反应生成的NaOH恰好反应.根据反应2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,过氧化钠的物质的量与离子的物质的量之比等于1:2,令过氧化钠的物质的量为xmol,则铝为2xmol,所以78x+54x=a,解得x=a132.所以生成气体为:
?2Na2O2+2H2O═4NaOH+O2↑,
?2? ?1?
? a132?mol?12×a132mol?
?2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
?2? 3
2×a132mol?3×a132mol
所以生成的气体体积为(12×a132mol+3×a132mol)×22.4L/mol=156.8a264L,
若只有过氧化钠,ag过氧化钠的物质的量为ag78g/molo=a78mol,生成气体为:
2Na2O2+2H2O═4NaOH+O2↑
?2? ?1?
a78mol?12×a78mol
所以生成气体体积为?12×a78mol×22.4L/mol=22.4a156L.
所以气体体积V的取值范围为22.4a156<V<156.8a264.
故答案为:22.4a156<V<156.8a264.
本题解析:
本题难度:一般
4、选择题 铝、 铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2即能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
参考答案:BC
本题解析:略
本题难度:简单
5、选择题 类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,不正确的是
[? ]
A.金属镁失火不能用二氧化碳灭火器灭火;金属钠失火也不能用二氧化碳灭火
B.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
C.不能用电解AlCl3溶液来制取金属铝;也不能用电解MgCl2溶液来制取金属镁
D.Al与S直接化合时可得到Al2S3;Fe与S直接化合时也可得到Fe2S3
参考答案:BD
本题解析:
本题难度:一般