1、填空题 写出下列方程式(10分 每空2分)
(1)金属铝和氢氧化钠溶液反应(离子方程式)??
(2)氢氧化亚铁放在空气中变为红褐色?
(3)工业制漂白粉?
(4)高温条件下铝和五氧化二钒(V2O5)反应?
(5)工业冶炼铝??
参考答案:(10分)(方程式考察注意气体符号)
(1)2Al+2OH-+2H2O==2AlO2-+3H2
(2)4Fe(OH)2+O2+2H2O="=4" Fe(OH)3
(3)2Cl2 +2Ca(OH)2==CaCl2+ Ca(ClO)2+2H2O
(4)10Al+3V2O5="=5" Al2O3+6V
(5)2Al2O3(熔融)="=4" Al+3O2
本题解析:根据所学习的知识便可做答。
点评:本题考查的是化学方程式的书写,题目难度不大,注意的是熟记教材知识是解题的关键。
本题难度:一般
2、选择题 下列有关金属铝及其化合物的叙述正确的是
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.氧化铝只能与酸反应,不能与碱反应
D.铝既能溶于酸,又能溶于强碱
参考答案:D
本题解析:铝在常温下能与氧气缓慢反应,A错误;铝能与氯气一定条件下反应,B错误;氧化铝是两性氧化物,既能与酸反应,又能与碱反应,C错误。D正确
本题难度:一般
3、填空题 如图所示:
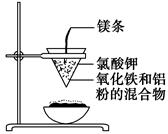
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
参考答案:(1)2Al+Fe2O3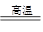 2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
本题解析:(1)铝热反应为2Al+Fe2O3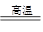 2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
(2)①②③④全为该铝热反应的现象。
(3)铝热反应实验中①为使熔融物易落下通常在内层纸漏斗底部剪一个孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙子;③反应中镁条引起氯酸钾分解;④氯酸钾引发铝热反应。
本题难度:简单
4、选择题 通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。阳离子E是(?)
A.可能是Al3+,也可能是Mg2+
B. 只能是Al3+
C.只能是Mg2+
D.以上说法都不对
参考答案:A
本题解析:常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,答案选A。
本题难度:一般
5、选择题 下列有关物质用途的叙述中,不正确的是
[? ]
A.二氧化硅可以用于制造变压器的铁芯材料
B.硫可用于制造黑火药
C.二氧化硅可用于制造光导纤维
D.氢氧化铝胶体既能吸附水中悬浮物,又能吸附色素,故可用于净水
参考答案:A
本题解析:
本题难度:简单