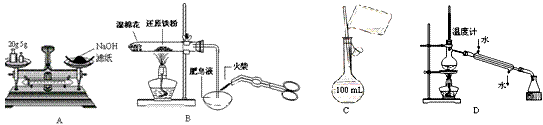
1、选择题 下列有关实验操作正确的是
?
[? ]
A.称量氢氧化钠固体?
B.检验铁粉与水蒸气反应产生的氢气
C.配制150mL 0.10mol/L盐酸?
D.分离两种互溶但沸点相差较大的液体混合物
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列可用于测定溶液PH且精确度最高的是
参考答案:B
本题解析:略
本题难度:简单
3、实验题 (12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
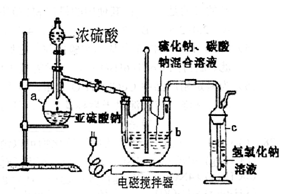
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是?;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:?。
(3)步骤③中不能将溶液蒸发至干的原因是?;晶膜通常在溶液表面出现的原因是?。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是?。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O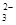 =2I-+S4O
=2I-+S4O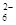 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
实验序号
| 1
| 2
| 3
|
Na2S2O3溶液体积(mL)
| 19.98
| 20.02
| 21.18
|
?
则该产品的纯度是____?,间接碘量法滴定过程中可能造成实验结果偏低的是____?。
A.滴定管末用Na2S2O3溶液润洗? B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗?D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
参考答案:26.(12分)(1)蒸馏烧瓶(1分)?(2)S2O32—+2H+= S↓+H2O+SO2↑(2分)
(3)蒸干会使硫代硫酸钠脱水并分解;(2分)因为溶液表面温度较低(2分)
(4) 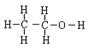 (1分) (5) 0.93;(2分) A B(2分)
(1分) (5) 0.93;(2分) A B(2分)
本题解析:(1)该仪器为圆底烧瓶;(2)酸性条件下,硫代硫酸钠可以和酸发生反应;(3)根据信息加热易分解,故蒸干会使硫代硫酸钠脱水并分解;形成晶膜是因为析出晶体,析出晶体是因为温度较低;(4)根据信息易溶于水,难溶于乙醇,故用乙醇来洗涤;(5)根据方程式找出关系式:IO3-—6S2O32-,根据碘酸根离子的物质的量求出硫代硫酸钠的物质的量浓度,求出250mL溶液中硫代硫酸钠晶体的质量,与总质量5g相比得纯度;未润洗,则使浓度偏小,测出硫代硫酸钠的质量偏小,故纯度偏小,滴定终点时仰视读数,则使体积偏大,浓度偏小,锥形瓶用蒸馏水润洗,对实验结果没影响,滴定管尖嘴处滴定前无气泡,滴定终点发现气泡,则使读出液体的体积变小,求出的浓度变大,故造成实验结果偏高;故选A、B。
本题难度:简单
4、选择题 浓H2SO4应贴下列哪个危险化学品的标志(? )
? 
A.6剧毒品
B.4遇湿易燃物品
C.8腐蚀品
D.6有害品(远离食品)
参考答案:C
本题解析:浓硫酸具有强烈的腐蚀性,属于腐蚀品,正确选项为C;
本题难度:简单
5、选择题 某同学用酒精灯给试管里的液体加热时,发现试管破裂。该同学认真分析后认为可能的原因有:
①用酒精灯的外焰给试管加热;②加热前没有擦干试管外壁的水;③加热时试管底部触及灯芯;
④被加热的液体超过试管容积的1/3;⑤加热过程中没有及时上下移动试管;⑥没有进行预热。
你认为该同学提出的原因可能正确的是
[? ]
A.①③⑥
B.②④
C.②③⑥
D.③④⑤
参考答案:C
本题解析:
本题难度:简单