1、选择题 认真研读课本是一种良好的学习习惯、按照课本所述,下列说法不正确的是(?)
A.护发素的主要功能是调节头发的pH,使之达到适宜的酸碱度
B.厕所清洁剂、醋、肥皂、厨房清洁剂的pH依次增大
C.仅用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液(仪器不限),就可以探究温度对化学反应速率的影响
D.将少量Mg(OH)2沉淀和适量氯化铵溶液混合,无明显现象
参考答案:D
本题解析:A.护发素的主要功能是调节头发的pH,使之达到适宜的酸碱度,正确,人体需要适宜的酸性环境;B.厕所清洁剂、醋、肥皂、厨房清洁剂的pH依次增大,正确;C.通过改变温度,可以测得温度对化学反应速率的影响,正确;D.将少量Mg(OH)2沉淀和适量氯化铵溶液混合,沉淀会溶解,由于氯化铵水解后呈酸性,错误。
本题难度:一般
2、实验题 (7分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是_? .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为? ?.
(3)实验①和②的目的是__________________________________________.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图.

分析上图能够得出的实验结论是?.
参考答案:(1)降低了活化能(1分)(2)H2O2 H++HO2-(2分)
H++HO2-(2分)
(3)探究浓度对反应速率的影响?(2分)?
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率(2分
本题解析:(1)由于催化剂能降低了活化能,所以可以增大反应速率。
(2)常温下5% H2O2溶液的pH约为6,说明双氧水可以看作是弱酸,因此电离方程式为H2O2 H++HO2-。
H++HO2-。
(3)实验①和②中双氧水的浓度不同,所以实验的目的是探究浓度对反应速率的影响。
(4)实验③、④、⑤中不同的是溶液的酸碱性,实验根据图像可判断,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
本题难度:一般
3、选择题 下列肯定能使化学反应速率增大的措施是
[? ]
A.增加反应物的量
B.增大压强
C.升高温度
D.使用催化剂
参考答案:C
本题解析:
本题难度:一般
4、实验题 (7分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2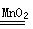 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号
| 条件
| 现象
| 结论
|
温度/℃
| 催化剂
|
1
| 40
| FeCl3溶液
|
|
|
2
| 20
| FeCl3溶液
|
|
|
3
| 20
| MnO2
|
|
|
4
| 20
| 无
|
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是
实验中可以表明该反应速率差异的现象是
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 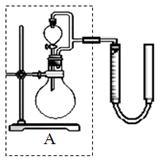
参考答案:(7分).①温度(1分) 比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异 产生气泡的快慢 ② 旋转分液漏斗的活塞,控制滴加H2O2溶液的速率 (除注明外每空2分)
本题解析:①根据表中数据可知,实验1和2中不同的是温度,所以实验1、2研究的是温度对H2O2分解速率的影响;实验2、3中不同的是催化剂,所以其实验的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异。
②避免反应过于剧烈方法是控制加入双氧水的速率,所以正确的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率。
考点:考查外界条件对反应速率的影响
点评:在判断或验证外界条件对反应速率的影响时,需要注意的是,不能同时改变2个或多个条件,否则无法验证或判断。应该是在其它条件不变的情况下,逐步改变进行验证。同时还需要设计对比实验,以保证实验的科学性和准确性。
本题难度:一般
5、选择题 下图表示反应X(g)+4Y(g)  5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
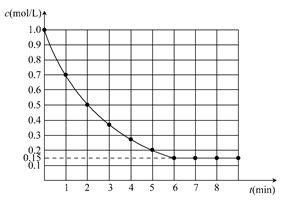
下列有关该反应的描述正确的是? ( )
A.若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变
B.若升高温度,则X的平衡转化率减小,v(逆)增大,v(正)减小
C.若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1:4
D.若平衡时X的转化率为85%,则起始时Y的物质的量浓度为3.4 mol/L
参考答案:C
本题解析:本题考查了化学反应速率和化学平衡的相关知识。A项,该反应前后气体体积不变,压缩体积,平衡不移动,但气体浓度变大,颜色加深;B项,升高温度时,正、逆反应速率均增大;C项,当X和Y按化学计量数之比投料时,平衡时二者的转化率相等;D项,平衡时,由X的转化率为85%可知Y的转化浓度为3.4 mol/L,则起始时Y的浓度必大于3.4 mol/L,故本题应选C。
本题难度:一般