1、填空题 现有A、B、C、D四种气体,A、B分别是由元素X和Y形成的单质,A是密度最小的气体,B在通常状况下呈黄绿色.在盛有A、B混合气体的集气瓶外点燃镁条时,可以引起爆炸并生成气体D.将D通入用硝酸酸化的AgNO3?溶液中时,立即出现白色沉淀.将气体C通入澄清的石灰水时,石灰水变浑浊.根据以上事实回答下列问题:
(1)C?的分子式可能是______,______.
(2)元素Y的原子在周期表中的位置是______,D的名称为______.
(3)元素X与Na可以形成一种离子化合物NaX,在该化合物中X的化合价为______,Na+离子半径比Y-半径______(“大”或“小”).
(4)写出B?与Ca(OH)2澄清溶液反应的离子方程式______.
参考答案:A是密度最小的气体为H2,X为H元素;B在通常状况下呈黄绿色为Cl2;Y为Cl元素;在盛有A、B混合气体的集气瓶外点燃镁条时,可以引起爆炸并生成气体D,所以D是HCl,将HCl通入用硝酸酸化的AgNO3 溶液中时,立即出现白色沉淀AgCl,将气体C通入澄清的石灰水时,石灰水变浑浊,说明C可能是二氧化碳或二氧化硫;
(1)依据上述推断,气体通入澄清石灰水变浑浊,二氧化碳和二氧化硫都可以反应生成沉淀,所以C 的分子式可能是:CO2、SO2;故答案为:CO2、SO2;
(2)元素Y是Cl元素,氯原子在周期表中的位置是第三周期,ⅤⅡA;D是HCl,名称是氯化氢;故答案为:第三周期,ⅤⅡA;氯化氢;
(3)元素X为氢元素与Na可以形成一种离子化合物NaH,该化合物中X的化合价为-1价;Na+离子半径比Cl-半径小,故答案为:-1;小;
(4)B 是Cl2与Ca(OH)2澄清溶液反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-=ClO-+Cl-+H2O
本题解析:
本题难度:一般
2、填空题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
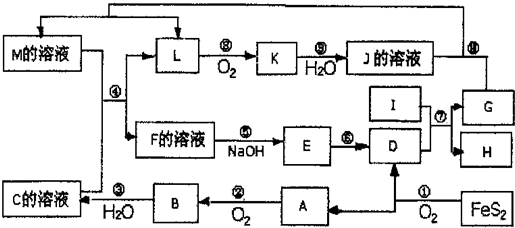
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法?。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:?。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是?。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为?。

参考答案:(1)四?Ⅷ(2分)(2)2:1(2分)
(3)取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色(其他合理答案)?(2分)(4)2Fe3++2I-=2Fe2++I2(2分)
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
②2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O(2分)
本题解析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为地壳中含量最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3。过量G与J溶液反应生成M,因此M应该是硝酸亚铁。由于D为Fe2O3,而由框图中可知E为氢氧化物,E经由一步转变为D,故E为Fe(OH)3,而E直接由F加入碱而得到,故F为三价铁离子,其阴离子可能为硫酸根与硝酸根的混合物,或者是仅有硫酸根离子,由于题目所给物质名称仅为F,故可知F为纯净物硫酸铁,则
(1)在周期表中,组成单质G的元素是铁位于第四周期第Ⅷ族。
(2)反应⑦是铝与氧化铁的铝热反应,方程式为2Al+Fe2O3 2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
(3)亚铁离子具有还原性,因此M溶液中亚铁离子的检验方法为取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色。
(4)铁离子具有氧化性,能把碘离子氧化生成单质碘,则反应的离子方程式为2Fe3++2I-=2Fe2++I2。
(5)根据电子得失守恒以及原子守恒可知,该反应的化学方程式是Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
(6)①镁和铝都是活泼的金属,极易被氧化,因此熔炼制备该合金时通入氩气的目的是防止Mg、Al被空气氧化。
②原电池中活泼的金属作负极失去电子被氧化,因此该原电池中铝是负极失去电子,AgO得到电子,由于电解质是氢氧化钠所以总的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
本题难度:困难
3、填空题 已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出下列元素的元素符号
A:?C:?E:?(各1分)
(2)画出 E的阴离子结构示意图:?(1分)
E的阴离子结构示意图:?(1分)
(3)A的单质和C的单质在一定条件下生成化合物X,用电子式表示X的形成过程?(2分);向X的水溶液中滴入酚酞溶液,会观察到?(1分)
(4)将9克B的单质在足量的D的单质中燃烧,所 得气体通入1L
得气体通入1L  1mol·L-1
1mol·L-1
NaOH溶液中,完全吸收后,溶液中大量存在的溶质是?,
且物质的量为?(各2分)
参考答案:(1)A:H? C:N? E:S?(各1分)
(2)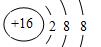 (1分)
(1分)
(3)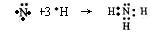 ?(2分);溶液变红色(1分)
?(2分);溶液变红色(1分)
(4)NaHCO3? Na2CO3(2分)n NaHCO3=0.5mol? n Na2CO3=0.25mol(2分)
本题解析:略
本题难度:一般
4、填空题 (10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C 的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
(1)C与D形成的化合物的电子式?.
(2)写出D的单质与CO2反应的化学方程式?.
(3)“嫦娥 一号”发射所用的液体燃料是上述?( 填元素名称)元素的单质.
一号”发射所用的液体燃料是上述?( 填元素名称)元素的单质.
(4)工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为?.
(5)在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0. 3 mol/L.[此时间内A2表示的化学反应速率为0. 45 mol/(L·s).则此段反应时间为?s
参考答案:(1)(略)? (2) 2Mg + CO2=C+ 2MgO? (3)氢? (4)接触室? (5)? 2
本题解析:略
本题难度:一般
5、填空题 (8分) X、Y、Z三种物质有如下转化关系:

(1)根据上述转化关系,写出下列物质的
化学式:X?、Y?、Z?
试剂甲?,试剂乙?
(2)写出上述③④⑤步反应的离子方程式:
参考答案:
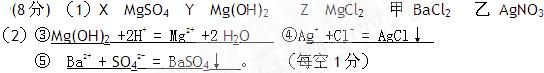
本题解析:略
本题难度:一般