1、选择题 下列离子方程式书写正确的是
A.单质铜与稀硝酸反应3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+4H2O
B.钠与水的反应 Na+2H2O=Na++2OH-+H2↑
C.氯气溶于水 Cl2 + H2O = 2H+ + ClO- + Cl-
D.碳酸氢钠跟盐酸反应CO32-+ 2H+= H2O + CO2
参考答案:A
本题解析:A、铜与稀硝酸反应放出一氧化氮气体,符合离子方程式的书写原则,正确;B、电荷不守恒,错误;C、次氯酸是弱酸,不能拆开,错误;D、碳酸氢根离子不能拆成氢离子和碳酸根离子形式,错误,答案选A。
本题难度:一般
2、选择题 离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是
[? ]
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A.①③?
B.①④⑤
C.②④⑤?
D.①⑤
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列离子方程式的书写正确的是(?)
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-= CO2↑+ H2O
B.少量铁和稀硝酸反应:3Fe +8H+ + 2NO3-=3Fe 2+ + 2NO↑+4 H2O
C.腐蚀印刷版电路的反应:Cu + Fe3+= Cu2++Fe2+
D.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-= CO32-+ H2O
参考答案:D
本题解析:A不正确,大理石难溶于水,用化学式表示;B中稀释过量,生成物是铁离子,B不正确;C中电子的得失不守恒,不正确,所以正确的答案选D。
本题难度:一般
4、选择题 下列离子方程式书写正确的是?(?)
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-= CO2↑+ H2O
B.稀盐酸与氢氧化钡溶液反应: H++OH-=H2O
C.硫酸镁溶液与氢氧化钡溶液反应:SO42- + Ba2+="=" BaSO4↓
D.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+ SO42-+ H+=" Ba" SO4↓+H2O
参考答案:B
本题解析:略
本题难度:简单
5、填空题 (10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。
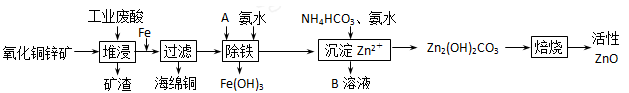
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
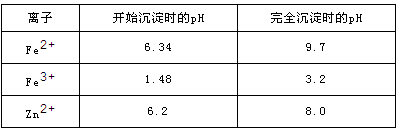
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的?。
A.KMnO4
B.O2
C.H2O2
D.Cl2