1、选择题 铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是
A.X是H2SO4
B.反应中Mn原子与Bi原子个数比为5:2
C.该反应中NaBiO3作氧化剂
D.该反应中Na2SO4既不是氧化产物,又不是还原产物
参考答案:C
本题解析:+5价Bi的化合物氧化性大于MnO4—,根据在同一个反应中氧化剂的氧化性大于氧化产物的氧化性,可知NaBiO3作为氧化剂,NaMnO4是氧化产物,此反应为:10 NaBiO3 + 4 MnSO4+ 14 H2SO4=" 4" NaMnO4+ 5Bi2(SO4)3+3 Na2SO4+14 H2O,反应中Mn原子与Bi原子个数比为2:5,B项错误。
本题难度:一般
2、选择题 下列实验能够达到实验目的是( )
A.
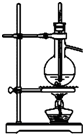
分离沸点相差较大的互溶液体混合物
B.
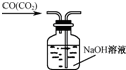
除去CO气体中得CO2气体
C.

电解饱和食盐水制氯气和氢气
D.
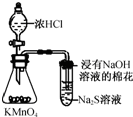
比较KMnO4、Cl2和S氧化性
参考答案:A.蒸馏操作时,温度计应位于蒸馏烧瓶支管口附近,用于测量馏分的温度,故A错误;
B.除去CO气体中得CO2气体,导管应长进短出,否则会导致洗气瓶内压强过大而将瓶塞顶开,故B错误;
C.电解饱和食盐水,阳极应为惰性电极,如用铜作阳极,在阳极上生成铜离子,不能得到氯气,故C错误;
D.高锰酸钾与浓盐酸反应生成氯气,氯气可与硫化钠反应生成单质S,可证明氧化性强弱,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 下列叙述中能肯定A金属比B金属金属性强的是? (? )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
参考答案:D
本题解析:A.比较元素金属性的强弱不能通过看原子最外层电子数的多少。错误。B. 比较元素金属性的强弱不能通过看原子核外电子层数的多少。错误。C.比较元素金属性的强弱不能也不能看金属与酸反应置换H2的多少。错误。D.金属活动性的强弱可以通过金属与水或酸置换出氢气的难易。活动性强的能够把水中是氢置换出来,活动性弱的不能把水中的氢置换出来。正确。
本题难度:一般
4、选择题 下表列举的各组事实中存在因果关系的是?(?)
选项
| 陈述Ⅰ(原因)
| 陈述Ⅱ(结果)
|
A
| O3能吸收紫外线
| 大气层中的O3被称为地球保护伞
|
B
| 钠原子核外电子数比铝少
| 钠的金属性比铝强
|
C
| 氯的非金属性比碘强
| 酸性:氢碘酸强于盐酸
|
D
| N2+3H2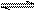 2NH3是放热反应 2NH3是放热反应
| 工业合成氨的反应在高温下进行
参考答案:A
本题解析:略
本题难度:简单
5、选择题 根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl?②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3?④I2+SO2+2H2O=2HI+H2SO4
A.Cl2>I2>Fe3+>SO24-
B.Cl2>Fe3+>I2>SO24-
C.Fe3+>Cl2>I2>SO24-
D.Cl2>Fe3+>SO24->I2
参考答案:B
本题解析:在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,据此可以判断。反应Cl2+2KI=I2+2KCl中氯气是氧化剂,单质碘是氧化产物,则氧化性强弱顺序是Cl2>I2;在反应2FeCl3+2HI=I2+2FeCl2+2HCl中氧化剂是氯化铁,氧化产物是单质碘,则氧化性强弱顺序是Fe3+>I2;反应2FeCl2+Cl2=2FeCl3中氯气是氧化剂,氯化铁是氧化产物,则氧化性强弱顺序是Cl2>Fe3+;反应I2+SO2+2H2O=2HI+H2SO4中氧化剂是单质碘,氧化产物是硫酸,所以氧化性强弱顺序是I2>SO24-,故氧化性强弱顺序是Cl2>Fe3+>I2>SO24-,答案选B。
本题难度:一般
|