1、选择题 下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
参考答案:A.ⅠA族为H和碱金属,ⅦA族元素为非金属元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,故A正确;
B.第二周期元素中,O、F没有正价,则第二周期元素从左到右,最高正价从+1递增到+5,故B错误;
C.同主族元素的简单阴离子还原性越强,越难水解,如卤族元素中,碘离子还原性最强,不水解,故C错误;
D.同周期金属元素的化合价越高,越难失去电子,如第三周期中,Na比Al容易失去电子,故D错误;
故选A.
本题解析:
本题难度:一般
2、填空题 下表是元素周期表的一部分,回答下列问题:
?主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩


|
(1)写出⑧元素的名称______.
(2)在这些元素中______是原子半径最大的元素;______是最活泼的非金属元素;______是最不活泼的元素.(写元素符号)
(3)①②③④这些元素的最高价氧化物对应的水化物中酸性最弱是______;气态氢化物水溶液呈碱性是_______.
(4)用电子式分别表示①和③、⑥和
化合物的形成过程:①和③______;⑥和
______.
(5)写出表示含有8个质子、10个中子的原子的化学符号______.
(6)具有三核10个电子的共价化合物分子的电子式是______.
参考答案:根据元素在周期表中的分布可以知道①是C,②是N,③是O,④是F,⑤Na,⑥是Mg,⑦是Al,⑧是Si,⑨是P,⑩是S,
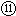
是Cl,最后一个是Ar.
(1)⑧元素的名称是硅,故答案为:硅;
(2)电子层越多半径越大,同周期元素原子从左到右原子半径逐渐减小,在这些元素中,原子半径最大的元素是Na,同周期元素原子从左到右非金属性逐渐增强,同主族从上到下,元素的非金属性逐渐减弱,所以非金属性最强的在右上角,即为F,稀有气体Ar的化学性质最稳定,故答案为:Na;F;Ar;
(3)同周期元素的原子从左到右最高价氧化物对应水化物的酸性逐渐增强,F没有正价,所以酸性:碳酸酸性弱于硝酸,氨气的水溶液氨水显碱性,故答案为:H2CO3;NH3;
(4)①和③形成的化合物二氧化碳是碳原子和氧原子间通过共价双键形成的共价化合物,形成过程为:
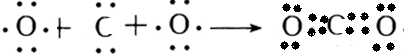
,⑥和
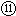
形成的化合物氯化镁是镁离子和氯离子间通过离子键形成的离子化合物,形成过程为:

,故答案为:
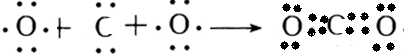
;

;
(5)含有8个质子,则为氧元素,10个中子,则质量数=质子数+中子数=10+8=18,根据原子表示法,该氧原子可以表示为:188O,故答案为:188O;
(6)具有三核10个电子的共价化合物分子是水分子,水的电子式是

,故答案为:

.
本题解析:
本题难度:一般
3、推断题 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是______,B是____,C是______,D是______,E是______。(填名称)
(2)由这五种元素组成的一种化合物是(写化学式)____ 。写出该物质的一种主要用途____________。
(3)写出C元素基态原子的电子排布式____________。
(4)用轨道表示式表示D元素原子的价电子构型____________。
参考答案:(1)氢;氧;铝;硫;钾
(2)KAl(SO4)2·12H2O;净水剂
(3)1s22s22p63s23p1(4)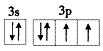
本题解析:
本题难度:一般
4、选择题 元素周期表中某区域的一些元素多用于制造半导体材料,它们是
[? ]
A.左下方区域的金属元素
B.右上方区域的非金属元素
C.金属元素和非金属元素分界线附近的元素
D.稀有气体元素
参考答案:C
本题解析:
本题难度:简单
5、选择题 X、Y、Z三种非金属,原子最外层电子数相等,等物质的量的单质X2、Y2、Z2分别与足量钠反应时,反应热为△Hx2>△Hy2>△Hz2,下列判断正确的是
A.原子半径:XB.气态氢化物的稳定性:HnXC.气态氢化物的沸点:HnX>HnY>HnZ
D.最高价氧化物对应的水化物的酸性可能为:HZO4
参考答案:B
本题解析:
本题难度:困难