|
高中化学知识点归纳《认识晶体》考点预测(2017年强化版)(八)
2018-03-17 05:19:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 关于下列几种离子晶体,说法不正确的是(?)
A.由于NaCl 晶体和CsCl晶体中正负离子半径比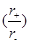 不相等,所以两晶体中离子的配位数不相等 不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
参考答案:D
本题解析:A、正确,氯化钠配位数为6,氯化铯的配位数为8;
B、是由于电荷不相同引起的,正确。
C、离子晶体,电荷越多,半径越小,晶格能越大;
D、熔沸点与分解温度不是一回事。错误
本题难度:一般
2、选择题 石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳质新材料,是构建富勒烯、纳米碳管的基本单元,有广泛的用途.下列说法正确的是( )
A.石墨烯是一种有机物
B.石墨烯中碳原子间以共价键结合
C.石墨烯具有和乙烯相同的性质
D.12g石墨烯中约含6.02×1023个e-
| 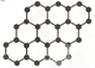
参考答案:A.石墨烯仅由碳原子构成,为单质,不是有机化合物,故A错误;
B.石墨烯中存在C-C键,为共价键,故B正确;
C.石墨烯不含C=C官能团,与乙烯的性质不同,故C错误;
D.12gC的物质的量为1mol,含电子数为6×6.02×1023个,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为

A.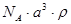
B.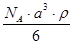
C.
D.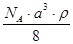
参考答案:A
本题解析:该立方体中含1个氯离子,Cs+个数=8×1/8=1,根据ρV=M/N知M=ρVNA=ρa3NA,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3 NA,故选A.
本题难度:一般
4、填空题 现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于
晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
参考答案:4:3? 1:1? 4? 4
本题解析:根据均摊法可知,甲中的晶胞中含有1个原子,而y原子的个数是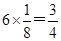 个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是 个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是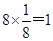 个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是 个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是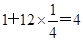 个,d离子的个数是 个,d离子的个数是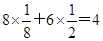 个。 个。
点评:该题是高考中的常见题型和重要的考点,侧重对学生能力的培养。该题的关键是明确均摊法的原理,然后结合题意和晶胞结构直接列式计算即可,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
5、简答题 硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
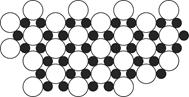
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。
参考答案:(1)1s22s22p63s23p63d104s24p1 N>O>B
(2)B—N键长比Si—Si短(或B—N键能较大)
(3)sp2杂化 正四面体 B原子最外电子层为L层,无d轨道;而Si原子最外层为M层,有d轨道,可参与杂化,使Si配位数增加至6
(4)MgB2
本题解析:(1)氮元素的2p轨道为半充满状态,较稳定,所以第一电离能比氧元素的大。(2)原子晶体中,共价键键长越短,键能越大,则硬度和耐热性越强。(3)中心原子杂化轨道数=σ键个数+孤电子对数,BF3分子的中心原子含有3个σ 键,没有孤电子对,杂化轨道数为3,采取sp2杂化;SiF4分子的中心原子含有4个σ 键,没有孤电子对,杂化轨道数为4,采取sp3杂化,空间构型为正四面体形;Si原子最外电子层含有d轨道,而B原子最外电子层不含d轨道。(4)由图可知,硼化镁晶体的晶胞结构为 ,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。 ,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。
本题难度:一般
| 