1、填空题 下列叙述中正确的是( )
①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更易被腐蚀;③电镀时,应把待镀件置于电解槽的阴极;④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极;⑤钢铁吸氧腐蚀时的正极反应式为2H2O+O2-4e-=4OH-.
A.①②④
B.①③④
C.①③④⑤
D.②④⑤
参考答案:①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,原电池能加速负极金属和电极质的反应速率,故①正确;
②白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Zn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故②错误;
③根据电镀原理中,镀件作阳极,待镀件置于电解槽的阴极,故③正确;
④用电解法精炼精铜时,粗铜作阳极,纯铜作阴极,故④正确;
⑤钢铁吸氧腐蚀时的正极发生氧气得电子的反应,即2H2O+O2+4e-=4OH-,故⑤正确.
故选B.
本题解析:
本题难度:一般
2、选择题 汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是

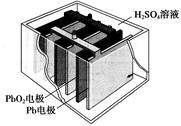
A.PbO2是电池的负极
B.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强
C.放电时,电子由Pb电极通过导线流向PbO2
D.正极的电极反应式为Pb-2e-=Pb2+
参考答案:C
本题解析:A.在该铅蓄电池PbO2是电池的正极 。错误。B.放电时,根据同种电荷相互排斥,异种电荷相互吸引的原则。溶液中的H+向阴极区移动,阴极区域的溶液的酸性增强。错误。C.放电时,Pb失去电子。在负极发生反应:Pb-2e-+SO42-= PbSO4;电子由Pb电极通过导线流向正极PbO2。正确。D.在正极的电极反应式为PbO2+2e-+4H+ +SO42-= PbSO4+2H2O。错误。
本题难度:简单
3、选择题 有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
[? ]
A. Y>Z>W>X
B. Z>Y>W>X
C. W>Z>Y>X
D. X>Y>Z>W
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列过程需要通电才能进行的是( )
①电离?②电解?③电镀?④电化学腐蚀.
A.①②
B.②③
C.②④
D.全部
参考答案:①电离是电解质在水溶液中离解出自由移动离子的过程,不需要通电,故①错误;
②电解池是外加电源强迫下的氧化还原反应,必须加外加电源,故②正确;
③电镀池实质是一个电解池,必须加外加电源,故③正确;
④电化学腐蚀原理是原电池原理,原电池中不含电源,是自发进行的氧化还原反应,故④错误.
故选B.
本题解析:
本题难度:简单
5、填空题
Zn+2MnO2+2NH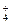 ===Zn2++Mn2O3+2NH3+H2O
===Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:___________负极:___________
干电池用久了就会变软,其原因是____________________________________________。
(2)正极反应中,前后经历了下列两个反应:
2NH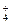 +2e-===2NH3+H2
+2e-===2NH3+H2
2MnO2+H2===Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由。
(3)在通电10 min的时间内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
(4)许多国家对废旧电池进行回收,从保护环境和节约能源解释为什么要回收废旧电池。
参考答案:
(1)2MnO2+2NH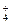 +2e-===Mn2O3+2NH3+H2O? Zn-2e-===Zn2+?有水产生,锌筒变薄?
+2e-===Mn2O3+2NH3+H2O? Zn-2e-===Zn2+?有水产生,锌筒变薄?
(2)正极反应中间产物H2附着于石墨,增加电池内阻。
(3)0.813 g;1.01×103 J。
(4)可以回收到大量的金属材料和化工原料。废旧电池有害于生态环境的物质在自然条件下极难被降解;废旧锌—锰干电池含有高浓度的氯化铵溶液,埋在土壤中会使土壤酸化,种子脱水死亡。
本题解析:这是一道物理、化学综合试题,涉及能量转化、原电池原理、环境保护及电路计算等知识。各问之间有渗透,但彼此间相对独立,学生思维空间有较大的自由度。
依题意:
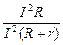 =75%,解得R="0.75" Ω。
=75%,解得R="0.75" Ω。
I=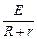 ="1.5" A。通电10 min消耗的电量为:Q=I·t="1.5" A×10×60 s="900" C。
="1.5" A。通电10 min消耗的电量为:Q=I·t="1.5" A×10×60 s="900" C。
转移电子的物质的量为:

9.34×10-3mol×87 g·mol-1="0.813" g。
外电阻消耗电能W=I2Rt="(1.5" A)2×0.75 Ω×600 s=1.01×103 J。
本题难度:简单