1、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.HCN易溶于水
B.1mol/L氢氰酸溶液的pH约为3
C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比盐酸溶液的弱
参考答案:B
本题解析:试题分析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在, 就证明了弱电解质。据此可知选项B正确。酸性强弱和溶解性没有关系,A不正确;C只能说明HCN是一元酸,不正确;D没有指明再相同条件下,不能说明,答案选B。
考点:考查弱酸的判断
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生解题能力的培养和训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、选择题 加入盐酸后,溶液中的离子数目不会明显较少的是
A.CO32-
B.Ag+
C.SO42-
D.HCO3-
参考答案:C
本题解析:分析:加入盐酸后,凡是与H+离子或Cl-离子反应的离子,离子数目会明显减少.
解答:A、H+离子与CO32-离子反应生成二氧化碳气体和水,离子数目会明显减少,故A错误;
B、Ag+离子与Cl-离子反应生成AgCl沉淀,离子数目会明显减少,故B错误;
C、SO42-离子与H+离子或Cl-离子都不反应,则离子数目不会明显减少,故C正确;
D、H+离子与HCO3-离子反应生成二氧化碳气体和水,离子数目会明显减少,故D错误.
故选C.
点评:本题考查离子共存问题,题目难度不大,注意溶液的酸碱性、颜色等隐性要求,从离子之间能否发生反应生成沉淀、气体、弱电解质、相互促进的水解等角度分析此类题目.
本题难度:一般
3、选择题 某温度下,水的离子积常数KW=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为
A.1∶10
B.9∶1
C.10∶1
D.99∶21
参考答案:B
本题解析:该温度下中性溶液的pH=6,故当混合溶液的pH=7,则说明中和过程中碱过量
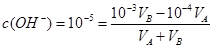 ,得
,得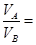 9:1,答案为B
9:1,答案为B
本题难度:困难
4、选择题 胶体能产生丁达尔现象的原因是胶粒使光线发生了
A.反射
B.散射
C.透射
D.折射
参考答案:B
本题解析:由于胶体微粒在1~100 nm之间,它对光有一定的散射作用,因而胶体有特定的光学性质——丁达尔现象.
本题难度:一般
5、选择题 欲使每10个水分子中溶有1个Na+,则90mL水中应投入氢氧化钠的质量为
A.23g
B.20g
C.11.5g
D.40g
参考答案:B
本题解析:
本题难度:一般