1、选择题 将4体积的H2和1体积的O2混合,4 g这种混合气体在标准状况下所占的体积是
A.5.6 L
B.11.2 L
C.22.4 L
D.33.6 L
参考答案:B
本题解析:要知道4 g该混合气体在标准状况下所占的体积,就需知道4 g该混合气体的物质的量,这就需先求出混合气体的平均摩尔质量(平均相对分子质量)
M=MA·A%+MB·B%+…="2" g·mol-1×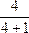 +32 g·mol-1×
+32 g·mol-1×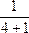 ="1.6" g·mol-1+6.4 g·mol-1="8?" g·mol-1
="1.6" g·mol-1+6.4 g·mol-1="8?" g·mol-1
4 g混合气体所占体积:V= ×22.4 L·mol-1="11.2" L。
×22.4 L·mol-1="11.2" L。
本题难度:简单
2、选择题 在标准状况下,将1g氦气11g二氧化碳和4g氧气混合,该混合气体的体积约为
A.28 L
B.11.2L
C.16.8L
D.14. 0L
参考答案:D
本题解析:
所以混合气体的总体积
本题难度:简单
3、选择题 在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-)=0.2mol/L,当加入等体积、某浓度的KOH溶液时,恰好沉淀完全,则所得溶液中K?+?的物质的量浓度是
A.0.2 mol/L
B.0.25 mol/L
C.0.1 mol/L
D.0.225 mol/L
参考答案:A
本题解析:由题意知,最后所得的溶液为K2SO4溶液,又因为加入的KOH溶液的体积与原溶液的体积相等,故最后所得的溶液中K+ 浓度为0.2 mol/L。
本题难度:简单
4、选择题 如图所示,在密闭容器内可移动活塞K的两侧分别充入空气(已知空气体积占整个容器容积的1/4) 和H2、O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复到原温度后,活塞右滑停留于容器的中央,则原来H2和O2的体积比可能最接近于

A.2:7
B.3:1
C.4:5
D.8:1
参考答案:C
本题解析:设氢气和氧气的物质的量分别是x和y,则空气的物质的量就是(x+y)/3。如果氢气过量,则剩余氧气就是(x+y)/3,参加反应的氧气是x/2,所以y-x/2=(x+y)/3,解得5x=4y。如果氢气过量,则x-2y=(x+y)/3,解得2x=7y。答案选C。
本题难度:简单
5、选择题 NA表示阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,2.24 L O3所含有的电子数为2.4NA
B.含有NA个Na+的Na2O溶解于1L蒸馏水中,所得溶液中c(Na+)="1" mol/L
C.42 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.25℃,1L纯水中含有的H+数为1×10-7NA
参考答案:B
本题解析:试题分析:臭氧含有24个电子,标准状况下,2.24L臭氧是0.1mol,A正确;B中溶液的体积不一定是1L,不能减少溶液的浓度,B不正确;乙烯和丙烯的最简式是相同的,都是CH2,则42 g乙烯和丙烯的混合气体中含有的碳原子的物质的量是42g÷14g/mol=3mol,C正确;常温下水中氢离子的浓度是1×10-7mol/L,则1L水中含有的H+数为1×10-7NA,D正确,答案选B。
考点:考查阿伏加德罗常数的有关计算和判断
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般