1、选择题 白磷与氧气可发生如下反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P
P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P O c kJ·mol-1、O
O c kJ·mol-1、O O d kJ·mol-1。
O d kJ·mol-1。
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
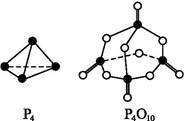
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
参考答案:A
本题解析:化学键断裂吸收的能量为(6a+5d)kJ,化学键形成放出的能量为(12b+4c)kJ。
本题难度:一般
2、选择题 下列热化学方程式及说法正确的是(? )
A.CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H= —890KJ
B.丁烷的燃烧热是2878 kJ/mol,则:
C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g)△H=" —2878kJ/mol"
C.2 mol氢气燃烧生成水蒸气放出484 kJ热量,
则:H2O(g)=H2(g)+1/2O2(g);△H="+242" kJ·mol-1
D.CH3COOH(aq)+KOH(aq)=CH3COOK(aq)+H2O(l)△H=-akJ·mol-1,a就为中和热的值
参考答案:B
本题解析:A项:△H的单位是kJ/mol,故错;C项:反应是放热反应,△H<0,故错;D项:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,故错。故选B。
点评:本题考查了热化学方程式的书写方法和注意问题,标注物质的聚集状态和反应的焓变是书写基本要求,题目较简单。
本题难度:简单
3、选择题 下列说法正确的是?(? )
A.据能量守恒定律,反应物的总能量一定等于生成物的总能量
B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
参考答案:C
本题解析:略
本题难度:一般
4、推断题 (14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
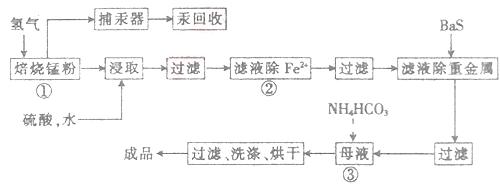
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:
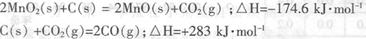
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55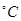 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
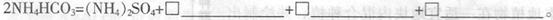
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
参考答案:28.(14分)(1)用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物(2分)
(2)MnO2(s)+C(s) = MnO(s)+CO(g)?△H=+54.2kJ·mol-1?(3分)
(3)1; MnCO3↓;1;H2O;1;CO2↑(全对给2分)
(4)H2O2(或其他氧化剂)(2分);? 3.7~8.6(2分)
(5)Mn2++ 2 H2O -2e-= MnO2 +4H+(3分)
本题解析:(1)该流程中用硫酸浸取的时候可以生成氢气;(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;(4)将
Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,故需加入双氧水,还原为水,不引入新的杂质,控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,故需控制pH为3.7~8.6;(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子。
本题难度:一般
5、选择题 已知热化学方程式: H2O(g)=H2(g) +1/2O2(g)?△H = +241.8kJ/mol
H2(g)+ 1/2O2(g)=H2O(1)?△H =" -" 285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是?(?)
A.吸热44kJ
B.吸热2.44KJ
C.放热44kJ
D.放热2.44KJ
参考答案:B
本题解析:略
本题难度:简单