1、选择题 下表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子的最外层电子数与电子总数之比为3:8。则下列说 法中正确的是
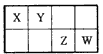
[? ]
A.四种元素中Z的非金属性最强
B.X元素只能形成一种单质
C.Y元素可形成多种氧化物
D.四种元素的最高价氧化物对应的水化物都是强酸
参考答案:C
本题解析:
本题难度:简单
2、填空题 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。?
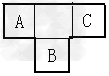
(1)写出A、B、C三种元素的名称_______?、_______?、_______?。
(2)B元素位于元素周期表中第_______?周期,第_______?族。
(3)C的原子结构示意图为_______?,用电子式表示C的单质与H2反应的过程:______________?。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有_______?。
参考答案:(1)氮;硫;氟?
(2)三?;ⅥA?
(3)“略”
(4)离子键、极性共价键
本题解析:
本题难度:一般
3、选择题 下列顺序不正确的是
A.热稳定性:HF>HCl>HBr>HI
B.微粒的半径:Cl->Na+>Mg2+>Al3+
C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
参考答案:C
本题解析:试题分析:A、根据同主族元素性质递变规律:同主族元素气态氢化物的稳定性由上到下逐渐减弱,正确;B、根据微粒半径大小比较原则可知,Cl-核外三个电子层,Na+?、? Mg2+?、? Al3+核外两个电子层则Cl-半径最大,Na+?、? Mg2+?、? Al3+电子层结构相同,核电荷数越大半径越小,即Cl->Na+>Mg2+>Al3+,正确;C、HCl和NaHCO3是强电解质,全部电离,CH3COOH为弱电解质,部分电离,错误;D、分散质粒子的直径:溶液小于1? nm?、胶体1? nm~100? nm、浊液大于100? nm,正确。
考点:考查元素周期律和物质分类相关知识
本题难度:简单
4、选择题 下列推断合理的是
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓H2SO4有强氧化性,但不能与Cu发生反应
D.SO2具有还原性,故可作漂白剂
参考答案:A
本题解析:A项明矾Al3+在水中能形成Al(OH)3胶体,可用作净水剂,正确;B项Na的金属活性比Mg强,但是钠在溶液中先与水反应,不可用Na与MgCl2溶液反应制Mg;C项 浓H2SO4有强氧化性,在加热条件下能与Cu发生反应;D项 SO2作漂白剂不是具有还原性的原因,而是能与有机色素化合。
点评:物质的性质平时的学习要形成系统性,就可以熟练快速解题。
本题难度:一般
5、填空题 下图为周期表中短周期的一部分,A,C两元素原子的核外电子数之和等于B原子的质子数。B原子的核内质子数和中子数相等。回答下列问题:
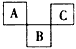
(1)A,B,C3种元素的名称分别是________、________、_________
(2)B元素在周期表中第_____周期______族。
参考答案:(1)氮;硫;氟
(2)三;ⅥA
本题解析:
本题难度:一般