1、选择题 研究气体在固体表面反应的化学已经成为化学学科的一个重要分支,它涉及生产、生活中的许多重要领域。下列不属于气体与固体作用的表面化学研究领域的是( )。
A.合成氨工业是将氮气和氢气在铁催化剂的表面转化成氨气
B.在燃料电池中,氢气和氧化剂在催化剂表面反应所产生的能量转化为电能
C.汽车中装有催化器,能将尾气中一氧化碳和氮氧化物转化为二氧化碳和氮气
D.加酶洗衣粉的乳化作用能将衣物纤维表面的油渍洗去
参考答案:D
本题解析:D项是在酶的催化作用下,油渍发生水解而易洗去,没有涉及气体,
故不属于气体与固体作用的表面化学领域。
本题难度:简单
2、选择题 2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔,以表彰他在界面化学研究领域取得的成就。下面实例中涉及到的变化都属于“界面化学”的范畴。其中正确的是
A.在汽车上安装催化转化器,使一氧化碳在催化剂表面氧化为二氧化碳,可减少一氧化碳的排放
B.泄漏在海洋中的原油可被海洋生物迅速分解而除去
C.铁生锈是铁与空气中的氧气、水蒸气直接化合生成了水合氧化铁(Fe2O3、nH2O)的结果
D.放置在空气中澄清石灰水表面出现的白色固体的主要成分是氢氧化钙
参考答案:A
本题解析:略
本题难度:简单
3、填空题 由美国通用原子能公司(GA)提出的碘硫循环被公认为是效率最高(预期转化率可达50%以上)、最有希望实现的热化学分解物质X的循环。其流程如下: ?
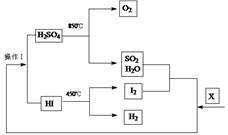
(1)物质X是_____________(填化学式);在此循环过程中,有一种物质,当作为反应物时只是还原剂,作为生成物时是还原产物,该化合物是__________。
(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、____________。
(3)氧缺位铁酸铜(CuFe2O4-x)可作上述流程中硫酸分解的催化剂。先在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为:____________;然后在______(填一常见气体)保护下,高温煅烧2h得到CuFe2O3.86,试计算1 mol CuFe2O3.86中Fe2+的物质的量为____mol。
(4)硫酸分解随温度等变化规律的实验结果如图所示,表示没有使用催化剂的曲线是______(填图中数字)。

参考答案:(1)H2O?、SO2 (2)酒精灯、冷凝管
(3)2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O ?氮气? 0.28?(4)③
本题解析:(1)由流程图可以看出物质X为H2O,在循环过程中SO2当作为反应物时只是还原剂。当作为生成物时是还原产物。(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、冷凝管、酒精灯。(3)在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O。然后在N2的保护作用下煅烧即得到CuFe2O3.86.假设在1 mol CuFe2O3.86中Fe2+的物质的量为x,则Fe3+物质的量为(2-x).根据在化合物中正负化合价的代数和为0的原则,可得1×2+2×x+3×(2-x)=2×3.86.解得x=0.28mol.(4)若没有使用催化剂,则反应分解需要的温度高。有图像可知应该是③。
本题难度:一般
4、填空题 (14分)纳米材料二氧化钛(TiO2)可做优良的催化剂。
资料卡片
|
物质
| 熔点/℃
| 沸点/℃
|
SiCl4
| -70
| 57.6
|
TiCl4
| -25
| 136.5
|
Ⅰ. 工业上二氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质 SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
②将SiCl4分离,得到纯净的TiCl4。
③在TiCl4中加水、加热,水解 得到沉淀TiO2·xH2O。
得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是__________________________________。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH c. OH+OH→H2O2
(3) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
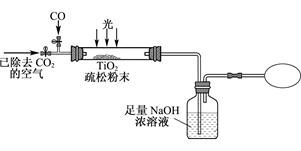
(5) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(6) 当CO气体全部通入后,还要通一会儿空气,其目的是?。
参考答案:

本题解析:略
本题难度:一般
5、选择题 将6.4克Cu投入到一定量的硝酸溶液中,Cu全部溶解,溶液中剩余H+amol则溶液中含NO3-的物质的量为mol.
A.0.2
B.a
C.0.2+a
D.不能确定
参考答案:C
本题解析:分析:根据Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,利用Cu(NO3)2中Cu与NO3-的关系及剩余硝酸来分析.
解答:由Cu投入到一定量的硝酸溶液中,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
可知Cu~2NO3-,
n(Cu)=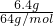 =0.1mol,
=0.1mol,
则溶液中n(NO3-)=0.1mol×2=0.2mol,
又溶液中剩余H+amol,则剩余硝酸中n(NO3-)=amol,
所以反应后溶液中n(NO3-)=amol+0.2mol=(0.2+a)mol,
故选C.
点评:本题考查硝酸的化学性质,明确反应及Cu与硝酸根离子的关系是解答本题的关键,难度不大.
本题难度:简单